题目内容
气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是( )
| A、1s22s22p63s23p2→1s22s22p63s23p1 |
| B、1s22s22p63s23p3→1s22s22p63s23p2 |
| C、1s22s22p63s23p4→1s22s22p63s23p3 |
| D、1s22s22p63s23p1→1s22s22p63s2 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:由原子核外电子排布可知A、B、C、D依次为Si、P、S、Al,结合同周期自左而右第一电离能具有增大趋势,注意P元素3p轨道半充满,电子能量较低,第一电离能高于同周期相邻元素.第一电离能越高,失去1个电子吸收的能量越多.
解答:
解:由原子核外电子排布可知A、B、C、D依次为Si、P、S、Al;Al、Si、P、S为同一周期元素,同周期自左而右第一电离能具有增大趋势,P元素原子的3p轨道为半充满,电子能量较低,P元素的第一电离能大,即P的第一电离能大于相邻元素,所以四种元素中第一电离能最大的是P.故P原子失去1个电子吸收的能量最多.
故选:B.
故选:B.
点评:本题考查核外电子排布规律、电离能的比较,题目难度中等,注意电离能的递变规律.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | ||||
| B、氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | ||||
| C、氯化铝溶液加入氨水:Al3++3OH-═Al(OH)3↓ | ||||
D、用氢氧化钠检验氯化铵溶液中铵根离子:NH4++OH-
|
化学美无处不在,如图是物质间发生化学反应的颜色变化,其中X是( )

| A、稀盐酸 |
| B、Na2SO4溶液 |
| C、稀硫酸 |
| D、Na2CO3溶液 |
下列事实不能用电化学理论解释的是( )
| A、轮船水线以下的船壳上装一定数量的锌块 |
| B、镀锌的铁比镀锡的铁耐用 |
| C、纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| D、铝片不用特殊方法保存 |
下列有关化学用语表示正确的是( )
| A、葡萄糖的结构简式:C6H12O6 | ||
| B、NaHCO3的电离:NaHCO3=Na++H++CO32- | ||
C、质子数为53、中子数为78的碘原子:
| ||
D、CO2的电子式: |
化学在人类生活中扮演着重要角色,以下说法或应用正确的是( )
| A、尿素是人类第一次合成的蛋白质 |
| B、光导纤维和合成纤维都属于有机高分子材料 |
| C、苯、汽油、无水乙醇都是纯净物 |
| D、煤经气化和液化两个化学变化过程,可变为清洁能源 |
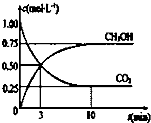 目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.
目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.