题目内容
有28gCuO和MgO固体混合物与200ml硫酸恰好完全反应,将反应后的溶液小心蒸干,得到固体68g.则原硫酸溶液的物质的量浓度和原固体混合物中氧元素的质量分数分别是( )
| A、2.5mol?L-1 28.57% |
| B、2.2mol?L-1 23.07% |
| C、1.5mol?L-1 24.55% |
| D、2.5mol?L-1 18.37% |
考点:元素质量分数的计算
专题:计算题
分析:CuO和MgO固体混合物与硫酸恰好完全反应,将反应后的溶液小心蒸干,得到固体68g为硫酸铜、硫酸镁的质量,由电荷守恒可知,CuO、MgO中氧原子物质的量等于硫酸根物质的量,固体质量之差为硫酸根质量与CuO、MgO中氧原子质量之差,据此计算解答.
解答:
解:CuO和MgO固体混合物与硫酸恰好完全反应,将反应后的溶液小心蒸干,得到固体68g为硫酸铜、硫酸镁的质量,由电荷守恒可知,CuO、MgO中氧原子物质的量等于硫酸根物质的量,
令硫酸的物质的量为xmol,则:
96x-16x=68-28
解得x=0.5
则原溶液中硫酸的物质的量浓度为
=2.5mol/L
原固体混合物中氧元素的质量分数为
×100%=28.57%
故选A.
令硫酸的物质的量为xmol,则:
96x-16x=68-28
解得x=0.5
则原溶液中硫酸的物质的量浓度为
| 0.5mol |
| 0.2L |
原固体混合物中氧元素的质量分数为
| 0.5mol×16g/mol |
| 28g |
故选A.
点评:本题考查混合物计算,关键是利用电荷守恒判断氧原子与硫酸根物质的量相等,再根据固体质量差计算,侧重考查学生分析计算能力,难度中等.

练习册系列答案
相关题目
下列有关化学用语表示正确的是( )
| A、葡萄糖的结构简式:C6H12O6 | ||
| B、NaHCO3的电离:NaHCO3=Na++H++CO32- | ||
C、质子数为53、中子数为78的碘原子:
| ||
D、CO2的电子式: |
实验室利用以下反应制取少量氮气:NaNO2+NH4Cl=NaCl+N2↑+2H2O,下列关于该反应的说法正确的是
( )
( )
| A、NaNO2发生氧化反应 |
| B、每生成1molN2时转移电子的物质的量为6mol |
| C、N2既是氧化产物,又是还原产物 |
| D、NH4Cl中的氮元素被还原 |
短周期主族元素X、Y、Z、W的原子序数依次递增.X的原子核中无中子;Y原子最外层电子数是内层的2倍;Z、W为同族元素,形成的WZ2分子是酸雨的主要成因.下列说法中正确的是( )
| A、X与Y形成原子个数比为1:1的化合物只有两种 |
| B、Y、W的氧化物均为酸性氧化物 |
| C、最高价氧化物对应水化物的酸性Y<W |
| D、X与Z形成的化合物中,各原子均满足8电子稳定结构 |
下列离子方程式书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+ |
| D、向NaOH溶液中滴入少量AlCl3溶液:Al3++4OH-═AlO2-+2H2O |
化学在人类生活中扮演着重要角色,以下说法或应用正确的是( )
| A、尿素是人类第一次合成的蛋白质 |
| B、光导纤维和合成纤维都属于有机高分子材料 |
| C、苯、汽油、无水乙醇都是纯净物 |
| D、煤经气化和液化两个化学变化过程,可变为清洁能源 |
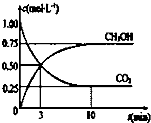 目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.
目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.