题目内容
4.用镍黑合金提取高纯氢的方法属于( )| A. | 重结晶纯化法 | B. | 萃取纯化法 | C. | 吸附纯化法 | D. | 蒸馏纯化法 |
分析 镍黑合金能吸附氢气,而不能吸附其它气体,从而把氢气与其它气体分离开.
解答 解:镍黑合金能吸附氢气,而不能吸附其它气体,从而把氢气与其它气体分离开,吸附纯化法;重结晶是分离固体混合物的方法,萃取是溶液中的分离方法,蒸馏分离液体混合物的方法,故C正确;
故选C.
点评 本题考查了物质的分离提纯方法,题目难度不大,注意把握常见的混合物的分离提纯方法,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
9.下列关于原子结构与元素性质的说法正确的是( )
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 全部由非金属元素组成的化合物中只含共价键 | |
| C. | ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 |
15.下列电极反应式与出现的环境相匹配的是( )
| 选项 | 电极反应式 | 出现的环境 |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═O2↑+2H2O | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | Cu-2e-═Cu2+ | 用铜做电极电解NaOH溶液的阳极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4溶液的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
19. 已知在298K和101kPa条件下,有如下反应:
已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
试回答下列问题:
(1)汽车尾气净化原理为反应Ⅳ:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•mol-1,该反应能自发进行的条件是低温.(填“高温”、“低温”或“任意温度”).
(2)如果在一定温度下,体积为 2 升的密闭容器中发生化学反应Ⅳ,0~4min各物质物质的量的变化如下表所示:
①求 0~2min 内用 CO 来表示的平均反应速率 v(CO)=0.10mol•Lˉ1•minˉ1.
②试计算该温度下反应Ⅳ的化学平衡常数 K=1.6.
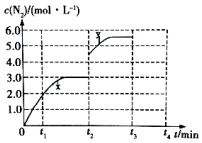
(3)若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L,c(N2)随时间 t 的变化曲线 x 如图所示.
①若在 t2min时改变一个条件,c(N2)随反应时间 t 的变化如曲线 y 所示,则改变的条件是快速将容器体积由3L压缩到2L.
②若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4内 c(N2)的变化曲线.
 已知在298K和101kPa条件下,有如下反应:
已知在298K和101kPa条件下,有如下反应:反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
试回答下列问题:
(1)汽车尾气净化原理为反应Ⅳ:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•mol-1,该反应能自发进行的条件是低温.(填“高温”、“低温”或“任意温度”).
(2)如果在一定温度下,体积为 2 升的密闭容器中发生化学反应Ⅳ,0~4min各物质物质的量的变化如下表所示:
| 物质(mol) 时间 | NO | CO | N2 | CO2 |
| 起始 | 0.40 | 1.0 | ||
| 2min 末 | 2.0 | 0.80 | 1.6 | |
| 4min 末 | 1.6 |
②试计算该温度下反应Ⅳ的化学平衡常数 K=1.6.
(3)若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L,c(N2)随时间 t 的变化曲线 x 如图所示.
①若在 t2min时改变一个条件,c(N2)随反应时间 t 的变化如曲线 y 所示,则改变的条件是快速将容器体积由3L压缩到2L.
②若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4内 c(N2)的变化曲线.
16.下列叙述或事实,能用勒夏特列原理解释的是( )
| A. | 为除去酸性CuCl2溶液中含有的少量Fe3+,可在加热、搅拌的条件下加入氨水,过滤后,再向滤液中加入适量盐酸 | |
| B. | 在工业合成NH3的反应中,采取高温措施 | |
| C. | 恒温下,对平衡体系H2(g)+Br2(g)?2HBr(g)加压,可使气体颜色变深 | |
| D. | 向饱和氯化钠溶液中不断缓慢地通入HCl气体,会析出晶体 |
13.一定条件下,乙烷发生分解反应:C2H6?C2H4+H2.一段时间后,反应达到平衡状态,这说明( )
| A. | 反应完全停止 | B. | 各物质的浓度保持不变 | ||
| C. | 反应物消耗完全 | D. | 正反应速率大于逆反应速率 |
14.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p4.则下列有关比较中正确的是( )
| A. | 电负性:④>③>②>① | B. | 原子半径:④>③>②>① | ||
| C. | 第一电离能:④>③>②>① | D. | 最高正化合价:④>③>②>① |
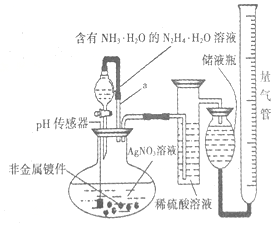 化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略):
化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略): .已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.
.已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.