题目内容
按要求完成下列问题.
(1)写出NH3的电子式: .
(2)写出基态Cr原子的简化电子排布式: .
(3)写出基态 Mg2+的电子排布图: .
(4)写出Zn原子的价电子排布式: .
(5)将Al、Si、P、S的第一电离能由小到大排列为 .
(6)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数: 、 、 .
(1)写出NH3的电子式:
(2)写出基态Cr原子的简化电子排布式:
(3)写出基态 Mg2+的电子排布图:
(4)写出Zn原子的价电子排布式:
(5)将Al、Si、P、S的第一电离能由小到大排列为
(6)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
考点:原子核外电子排布,电子式,元素电离能、电负性的含义及应用,配合物的成键情况
专题:
分析:(1)NH3为共价化合物,N分别于3个H形成3对共用电子;
(2)Cr为24号元素,原子核外电子数为24,其中3d能级达到半满;
(3)Mg2+含有10个核外电子,电子排布式为1s2 2s22p6;
(4)锌是30号元素,基态原子核外有30个电子,其3d、4s能级上电子是其价电子;
(5)同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的;
(6)根据配合物K3[Co(CN)6]结构分析中心离子为Co3+、配体为CN-、配位数为6.
(2)Cr为24号元素,原子核外电子数为24,其中3d能级达到半满;
(3)Mg2+含有10个核外电子,电子排布式为1s2 2s22p6;
(4)锌是30号元素,基态原子核外有30个电子,其3d、4s能级上电子是其价电子;
(5)同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的;
(6)根据配合物K3[Co(CN)6]结构分析中心离子为Co3+、配体为CN-、配位数为6.
解答:
解:(1)NH3为共价化合物,N分别于3个H形成3对共用电子,电子式为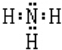 ,故答案为:
,故答案为: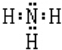 ;
;
(2)Cr为24号元素,原子核外电子数为24,其中3d能级达到半满,简化电子排布式为[Ar]3d54s1,故答案为:[Ar]3d54s1;
(3)Mg2+含有10个核外电子,电子排布式为1s2 2s22p6,核外电子排布图为 ,
,
故答案为: ;
;
(4)锌是30号元素,基态原子核外有30个电子,其3d、4s能级上电子是其价电子,所以Zn原子的价电子排布式为3d104s2,
故答案为:3d104s2;
(5)Al、Si、P、S均属于第三周期元素,第一电离能随着原子序数的增大而增大,但P为第ⅤA族的大于第ⅥA族的S,因此第一电离能:Al<Si<S<P,
故答案为:Al<Si<S<P;
(6)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+;CN-;6.
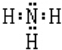 ,故答案为:
,故答案为: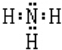 ;
;(2)Cr为24号元素,原子核外电子数为24,其中3d能级达到半满,简化电子排布式为[Ar]3d54s1,故答案为:[Ar]3d54s1;
(3)Mg2+含有10个核外电子,电子排布式为1s2 2s22p6,核外电子排布图为
 ,
,故答案为:
 ;
;(4)锌是30号元素,基态原子核外有30个电子,其3d、4s能级上电子是其价电子,所以Zn原子的价电子排布式为3d104s2,
故答案为:3d104s2;
(5)Al、Si、P、S均属于第三周期元素,第一电离能随着原子序数的增大而增大,但P为第ⅤA族的大于第ⅥA族的S,因此第一电离能:Al<Si<S<P,
故答案为:Al<Si<S<P;
(6)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+;CN-;6.
点评:本题考查较为综合,考查核外电子排布规律、电子式、核外电子排布式(图)的书写、配合物的结构等,侧重于原子结构、原子核外电子排布规律的应用,题目难度中等.

练习册系列答案
相关题目
下列各基态原子和离子的电子排布式错误的是( )
| A、Ca2+ 1s22s22p63s23p6 |
| B、F- 1s22s23p6 |
| C、S2- 1s22s22p63s23p4 |
| D、Ar 1s22s22p63s23p6 |
下列几种元素的表达式错误的是( )
A、F-的电子排布图: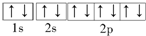 |
B、Na+的结构示意图: |
| C、Mg2+的电子排布式:1s22s22p6 |
| D、Cr的简化电子排布式:[Ar]3d44s2 |
下列原子各电子层中电子数不合理的是( )
| A、Sc:K(2)L(8)M(8)N(3) |
| B、Cr:K(2)L(8)M(13)N(1) |
| C、Ge:K(2)L(8)M(18)N(4) |
| D、Cu:K(2)L(8)M(18)N(1) |
下列分子或离子中,中心原子含有孤电子对的是( )
| A、H3O+ |
| B、SiH4 |
| C、PH3 |
| D、SO42- |
常温下,下列叙述不正确的是( )
| A、在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a<b |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH<8.0 |
| D、若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11 |
 ,该氧化物的化学式为
,该氧化物的化学式为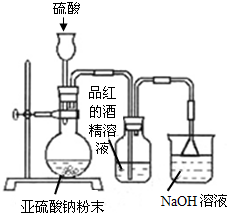 某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.