题目内容
下列分子或离子中,中心原子含有孤电子对的是( )
| A、H3O+ |
| B、SiH4 |
| C、PH3 |
| D、SO42- |
考点:原子核外电子排布,共价键的形成及共价键的主要类型
专题:原子组成与结构专题
分析:分子中孤电子对个数=
(中心原子价电子数-配原子个数×配原子形成稳定结构需要的电子数),阳离子中孤电子对个数=
(中心原子价电子数-电荷数-配原子个数×配原子形成稳定结构需要的电子数),阴离子中孤电子对个数=
(中心原子价电子数+电荷数-配原子个数×配原子形成稳定结构需要的电子数),据此分析解答.
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
解答:
解:A、水合氢离子中孤电子对个数=
(6-1-3×1)=1,故A正确;
B、SiH4中孤电子对个数=
(4-4×1)=0,故B错误;
C、PH3中孤电子对个数=
(5-3×1)=1,故C正确;
D、SO42-中孤电子对个数=
(6+2-4×2)=0,故D错误;
故选AC.
| 1 |
| 2 |
B、SiH4中孤电子对个数=
| 1 |
| 2 |
C、PH3中孤电子对个数=
| 1 |
| 2 |
D、SO42-中孤电子对个数=
| 1 |
| 2 |
故选AC.
点评:本题考查了化合物中孤电子对个数的计算方法,根据价层电子对互斥理论计算即可,注意其阴阳离子孤电子对个数的计算方法,为易错点,该考点常常与分子的空间构型、原子的杂化方式联合考查,题目难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
已知某元素的前8个电离能(I1/kJ?mol-1):I1=577,I2=1820,I3=2740,I4=11600,I5=14800,I6=18400,I7=23400,I8=27500.该元素原子的最外层有几个电子?( )
| A、1个 | B、2个 | C、3个 | D、4个 |
下列与有机物相关的叙述正确的是( )
| A、CH4O与C2H6O一定互为同系物 |
| B、1mol C6H6(苯)中含有3mol碳碳双键 |
| C、用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质 |
| D、向乙酸乙酯中加入NaOH 溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸 |

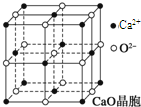 可以由下列反应合成三聚氰胺:CaO+3C
可以由下列反应合成三聚氰胺:CaO+3C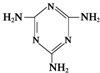 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸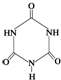 后,三聚氰酸与三聚氰胺分子相互之间通过
后,三聚氰酸与三聚氰胺分子相互之间通过 FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题: