题目内容
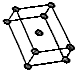
12.下面有关晶体的叙述中,不正确的是( )| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 石墨晶体中只有共价键,不存在其他的作用力 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
分析 A、根据金刚石的结构模型 判断;
判断;
B、石墨晶体层内是共价键,层与层之间是分子间作用力;
C.氯化铯晶体中,铯离子的配位数是8;
D.二氧化碳晶体中每个二氧化碳分子周围紧邻12个二氧化碳分子.
解答 解:A、金刚石的结构为 ,由模型可知最小的环为六元环,故A正确;
,由模型可知最小的环为六元环,故A正确;
B、石墨晶体层内是共价键,层与层之间是分子间作用力,故B错误;
C.根据氯化铯晶体晶胞结构知,每个晶胞中含有一个铯离子,每个顶点上的氯离子被8个晶胞共用,每个氯离子周围最近的铯离子是8,故C正确;
D.二氧化碳晶体属于面心立方,每个二氧化碳分子周围紧邻二氧化碳分子个数=3×8÷2=12,故D正确.
故选B.
点评 本题考查了晶体的空间结构,明确典型的晶体类型、结构、晶胞为解答本题关键,同时要求学生有丰富的空间想象能力,难度较大.

练习册系列答案
相关题目
2.下列有关说法错误的是( )
| A. | 使用热的纯碱水洗手时更容易除去手上的油脂污垢 | |
| B. | 若发现厨房内天然气发生了泄漏,应立即打开门窗 | |
| C. | 用无水硫酸铜检验酒精中含有水的过程中发生了化学变化 | |
| D. | 抗战胜利70周年阅兵式上释放的气球中充入的是氢气 |
3.下列结论正确的是( )
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | ①②⑤⑦ | B. | ②③④⑥ | C. | ②④⑤⑥⑦ | D. | ①②⑥⑦ |
20.下列哪种物质可以鉴别乙醇和苯酚( )
| A. | NaCl溶液 | B. | NaHCO3溶液 | C. | H2SO4溶液 | D. | FeCl3溶液 |
17.关于乙醇与钠的反应,下列说法中正确的是( )
| A. | 说明乙醇分子中含有氢原子 | |
| B. | 说明乙醇分子中含有氧原子 | |
| C. | 说明乙醇分子中含有氢离子 | |
| D. | 说明乙醇分子中含有不同于烃分子里的氢原子 |
1.下列有关说法正确的是( )
| A. | △H>0的反应一定不能自发进行 | |
| B. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | |
| C. | 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 | |
| D. | 在5NH4NO3=2HNO3+4N2↑+9H2O中,生成28gN2时转移的电子数目为3.75mol |
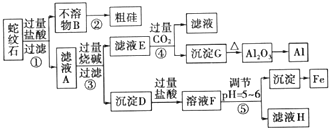
12.蛇纹石矿可以看做由MgO、Fe2O3、Al2O3和SiO2组成,某实验小组设计如下流程欲分别制得单质Mg、Fe、Al和Si.
有关氢氧化物沉淀时的pH见表
请回答下列问题:
(1)滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+
(2)操作②中涉及的化学方程式为2C+SiO2 $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)除去MgCl2溶液中的HCl,可以选用的试剂为cd(填字母)
a.NaOH溶液 b.氨水c.MgO d.Mg(0H)2
(4)由滤液H制取金属Mg的流程如下:
滤液H$\stackrel{加热浓缩}{→}$ $\stackrel{冷却结晶}{→}$MgCl2•6H2O$\stackrel{脱水}{→}$MgCl2→Mg
该流程中由MgCl2冶炼Mg的方法是电解
(5)工业上常用碱液除去铝表面的氧化膜,碱洗时常有气泡冒出,原因是2Al+2OH-+2H2O═2AlO2-+3H2↑(用离子方程式表示),为将碱洗液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的b
a.NH3 b.CO2c.NaOH d.HNO3.

有关氢氧化物沉淀时的pH见表
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
(1)滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+
(2)操作②中涉及的化学方程式为2C+SiO2 $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)除去MgCl2溶液中的HCl,可以选用的试剂为cd(填字母)
a.NaOH溶液 b.氨水c.MgO d.Mg(0H)2
(4)由滤液H制取金属Mg的流程如下:
滤液H$\stackrel{加热浓缩}{→}$ $\stackrel{冷却结晶}{→}$MgCl2•6H2O$\stackrel{脱水}{→}$MgCl2→Mg
该流程中由MgCl2冶炼Mg的方法是电解
(5)工业上常用碱液除去铝表面的氧化膜,碱洗时常有气泡冒出,原因是2Al+2OH-+2H2O═2AlO2-+3H2↑(用离子方程式表示),为将碱洗液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的b
a.NH3 b.CO2c.NaOH d.HNO3.
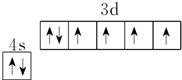 .
.