题目内容
4.玛瑙是石英的变种,是由SiO2沉积而成的隐晶质石英,因含有Fe、Al、Ti、Mn和X等元素而呈现灰、白、红、淡褐色等多种色彩.请回答下列问题:
(1)SiO2分为晶态和无定形两大类,可通过X射线衍射方法区分晶态SiO2和无定形SiO2.
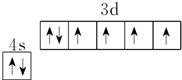
(2)基态铁原子的价电子排布图为
 .
.(3)SiO2中Si和O两种元素电负性大小关系为O>Si,Fe(OH)3的碱性<Al(OH)3碱性.
(4)SiCl4主要用于制硅酸酯类、有机硅单质、高温绝缘漆和硅橡胶.SiCl4的熔点:203.2K,沸点:330.8K,下列关于SiCl4的说法正确的是( )
A.SiCl4为分子晶体
B.SiCl4中Si的杂化方式为sp3杂化
C.SiCl4的立体几何构型为三角锥形
D.SiCl4中Si和Cl两元素均达到8e-稳定结构
(5)金属钛有“生物金属”、“现代金属”和“战略金属”等美誉,其晶胞结构如图:
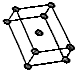
①金属钛的空间利用率为74%,配位数为12.
②若其晶胞体积为V,阿伏加德罗常数的值用NA表示,则金属钛的密度为$\frac{96}{V{N}_{A}}$g•cm-3(只列式不计算).
分析 (1)通过X射线衍射区分晶态SiO2和无定形SiO2;
(2)Fe原子价电子排布式为3d64s2,结合泡利原理、洪特规则画出价电子排布图;
(3)非金属性越强,电负性越大;金属性越强,最高价氧化物对应水化物的碱性越强;
(4)SiCl4的熔沸点比较低,属于分子晶体,分子中Si原子形成4个Si-Cl键,Si原子没有孤对电子,杂化轨道数目为4,为正四面体结构,分子中原子均满足8电子结构;
(5)①Ti是六方最密堆积;
②结合晶胞中原子数目,表示出晶胞的质量,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)通过X射线衍射区分晶态SiO2和无定形SiO2,故答案为:X射线衍射;
(2)Fe原子价电子排布式为3d64s2,结合泡利原理、洪特规则画出价电子排布图为 ,
,
故答案为: ;
;
(3)非金属性越强,电负性越大,非金属性O>Si,则电负性O>Si;金属性越强,最高价氧化物对应水化物的碱性越强,金属性Al>Fe,则碱性Fe(OH)3<Al(OH)3,
故答案为:O>Si;<;
(4)A.SiCl4的熔沸点比较低,属于分子晶体,故A正确;
B.分子中Si原子形成4个Si-Cl键,Si原子没有孤对电子,杂化轨道数目为4,Si原子采用sp3杂化,故B正确;
C.根据价层电子对互斥理论知,为正四面体结构,故C错误;
D.该分子中原子均满足8电子结构,故D正确,
故选:ABD;
(5)①Ti是六方最密堆积,空间利用率是74%,配位数为12,
故答案为:74%;12;
②晶胞质量为2×$\frac{48}{{N}_{A}}$g,若其晶胞体积为V,则晶胞密度=2×$\frac{48}{{N}_{A}}$÷V=$\frac{96}{V{N}_{A}}$,
故答案为:$\frac{96}{V{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、元素周期律、分子结构、晶体类型与性质、晶胞计算等,(5)中空间利用率计算关键是理解原子半径与晶胞棱长关系.

 阅读快车系列答案
阅读快车系列答案| A. | 金刚石 | B. | 氯化钠 | C. | 氢氧化钠 | D. | 碘 |
| A. | 100 mL | B. | 45 mL | C. | 10 mL | D. | 15 mL |
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 石墨晶体中只有共价键,不存在其他的作用力 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
| A. | C2H6和C4H8 | B. | C3H6和C6H14 | C. | C8H18和C4H10 | D. | C5H12和C7H14 |
| A. | “水滴石穿”是溶解了CO2的雨水与CaCO3的长期作用,生成了可溶性的Ca(HCO3)2 | |
| B. | 新型水处理剂高铁酸钠(Na2FeO4),因为具有强氧化性,所以能对水进行消毒,同时,还原产物能形成带电的氢氧化铁胶体,能使水中的杂质沉降而达到净水的目的 | |
| C. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可以缓解白色污染 | |
| D. | 如果人觉察到室内煤气浓度较高的时候,应该将头尽量贴地,匍匐行进至门口或者窗口,不要急着打开电灯 |
用4.0mL 0.001mol/L KMnO4溶液与2.0mL 0.010mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
| 实验组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2.0mL | 20 | / |
| Ⅱ | 2.0mL | 20 | 少量MnSO4粉末 |
| Ⅲ | 2.0mL | 30 | / |
| Ⅳ | 1.0mL | 20 | 1.0mL蒸馏水 |
(2)本实验可通过观察高锰酸钾溶液完全褪色的时间来比较各组反应的反应速率大小,要观察到预期现象,草酸的物质的量必须满足过量(填“过量”、“恰好完全反应”或“不够反应量”)的条件.
(3)对比实验I和II,可以研究催化剂对化学反应速率的影响.
(4)对比实验I和IV,可以研究H+的浓度(或硫酸溶液的浓度)对化学反应速率的影响,实验IV加人1.0mL蒸馏水的目的是确保溶液总体积相同,仅改变硫酸的浓度,而高锰酸钾浓度和草酸浓度都相同.

实验 记录 | ①Zn质量减少,Cu质量不变; ②外电路电流方向是:由Cu→Zn; ③SO42- 向Cu极移动; ④Zn电极发生氧化反应; ⑤正极反应式:Cu2++2e-═Cu |
| A. | ①②④ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
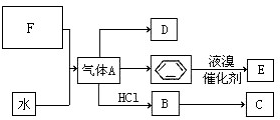 已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空: ;C的结构简式
;C的结构简式 ;
; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应;
+HBr,其反应类型为取代反应;