题目内容
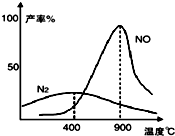 氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):①4NH3(g)+5O2(g)?4NO(g)+6H2O(l)△H=-a kJ?mol-1
②4NH3(g)+3O2(g)?2N2(g)+6H2O (l)△H=-b kJ?mol-1
温度较低时以生成
考点:化学平衡的影响因素
专题:化学平衡专题
分析:根据图象可知温度低时生成氮气,温度高时生成NO,但该反应为放热反应,则温度高于900℃时,NO产率下降,利用勒夏特列原理书写热化学方程式.
解答:
解:根据图象可知温度低时生成氮气;温度高时生成NO,但该反应为放热反应,则温度高于900℃时,NO产率下降;
已知①4NH3(g)+5O2(g)?4NO(g)+6H2O(l)△H=-a kJ?mol-1
②4NH3(g)+3O2(g)?2N2(g)+6H2O (l)△H=-b kJ?mol-1
(①-②)÷2得:N2(g)+O2(g)=2NO(g)△H=+(b-a)/2 kJ?mol-1
故答案为:N2;氨气氧化生成NO的反应是放热反应,升高温度转化率下降;N2(g)+O2(g)=2NO(g)△H=+(b-a)/2 kJ?mol-1.
已知①4NH3(g)+5O2(g)?4NO(g)+6H2O(l)△H=-a kJ?mol-1
②4NH3(g)+3O2(g)?2N2(g)+6H2O (l)△H=-b kJ?mol-1
(①-②)÷2得:N2(g)+O2(g)=2NO(g)△H=+(b-a)/2 kJ?mol-1
故答案为:N2;氨气氧化生成NO的反应是放热反应,升高温度转化率下降;N2(g)+O2(g)=2NO(g)△H=+(b-a)/2 kJ?mol-1.
点评:本题考查了利用图象的分析试剂、勒夏特列原理,题目难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、水的离子积Kw随温度、外加酸(碱)浓度的改变而改变 |
| B、能自发进行的化学反应,一定是△H<0、△S>0 |
| C、当弱电解质电离成离子的速率与离子结合成分子的速率相等时达到电离平衡状态 |
| D、Ksp不仅与难溶电解质的性质和温度有关,还与溶液中的离子浓度有关 |
设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、25℃,pH=2的HCl溶液中含有H+的数目为0.01NA |
| B、1mol Na2O2固体中含有的阴阳离子总数为4 NA |
| C、1mol碳烯(:CH2)中含有的电子数8NA |
| D、5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
下列解释实验过程或事实的反应方程式不正确的是( )
| A、熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH═Na2SiO3+H2O | ||||
| B、在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O | ||||
C、红热的铁丝与水接触,表面形成黑色保护层:3Fe+4H2O(g)
| ||||
| D、“84消毒液”(有效成分NaClO)和“洁厕灵“(主要成分盐酸)混合使用放出氯气:ClO-+Cl-+2H+=Cl2↑+H2O |
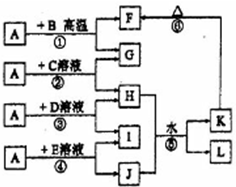 如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答: