题目内容
2.甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁
(1)转化关系中所涉及的反应为非氧化还原反应,且乙为水. 若甲为固体,甲和乙反应生成的丙和丁是两种碱性物质,反应的方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
(2)转化关系中所涉及的反应为氧化还原反应,且乙为水.
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
②若丙和丁都可在一定条件下还原CuO,甲+乙→丙+丁
写出该反应的化学方程式:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
③若甲是由N和O元素组成的气态红棕色物质.将3.36g Fe加到一定量丙稀溶液中,收集到1.12L气体丁(已折算为标准状况),则反应的离子方程6 Fe+20H++5NO3-=3Fe2++3Fe3++5NO↑+10H2O.
分析 (1)转化关系中所涉及的反应为非氧化还原反应,且乙为水. 若甲为固体,甲和乙反应生成的丙和丁是两种碱性物质,则甲为Mg3N2,反应生成氢氧化镁与氨气;
(2)转化关系中所涉及的反应为氧化还原反应,且乙为水.
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,甲为Na,丙为氢气,为钠与水反应生成氢氧化钠与氢气;
②若丙和丁都可在一定条件下还原CuO,丙、丁具有还原性,可以是碳与水反应生成氢气与CO;
③若甲是由N和O元素组成的气态红棕色物质,则甲为NO2,将3.36gFe加到一定量丙稀溶液中,收集到1.12L气体丁(已折算为标准状况),则丙为硝酸,丁为NO,根据电子转移守恒、Fe的质量计算溶液中铁离子、亚铁离子物质的量,书写离子方程式.
解答 解:(1)甲和乙的反应为非氧化还原反应,且乙为水,若甲为固体,甲和乙反应生成的丙和丁是二种弱碱,应是氮化镁水解生成氢氧化镁与氨水,故甲为Mg3N2,反应方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑,
故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(2)反若甲和乙的反应为氧化还原反应,且乙为水.
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,应是Na与水反应生成氢氧化钠与氢气,钠和水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
②若丙和丁都可在一定条件下还原CuO,丙、丁具有还原性,可以是碳与水反应生成氢气与CO,所以该反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,
故答案为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;
③若甲是由N和O元素组成的气态红棕色物质,则甲为NO2,将3.36gFe加到一定量丙稀溶液中,收集到1.12L气体丁(已折算为标准状况),则丙为硝酸,丁为NO,NO物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,Fe的物质的量为:$\frac{3.36g}{56g/mol}$=0.06mol,设溶液中铁离子、亚铁离子物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.06}\\{3x+2y=0.05×3}\end{array}\right.$
解得x=y=0.03,
故反应离子方程式为:6 Fe+20H++5NO3-=3Fe2++3Fe3++5NO↑+10H2O,
故答案为:6 Fe+20H++5NO3-=3Fe2++3Fe3++5NO↑+10H2O.
点评 本题考查无机物的推断,明确物质的性质及常见反应类型是解本题关键,需要学生熟练掌握元素化合物性质,难度中等.

| A. | 燃烧产物只有CO2和H2O | B. | 与溴水发生取代反应 | ||
| C. | 都难溶于水 | D. | 通常不与强酸、强碱、强氧化剂反应 |
| A. | CH3CHO+H2$\stackrel{Ni}{→}$CH3CH2OH | |
| B. | CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O | |
| C. | CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O | |
| D. | 2CH3CHO+O2$\stackrel{△}{→}$2CH3COOH |
| A. | 纯水不导电,所以水不是电解质 | |
| B. | SO3水溶液的导电性很强,所以SO3是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | Na2O液态时能导电,所以Na2O是电解质 |
| 实验事实 | 结论 | |
| A | A元素的原子半径比B元素的原子半径大 | 周期表中A位于B的下一周期 |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| C | 常温下,铜能与浓硝酸反应而铝被浓硝酸钝化 | 还原性:Cu>Al |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| A. | A | B. | B | C. | C | D. | D |
| A. | 服用阿司匹林过量出现水杨酸(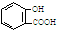 )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: | |
| B. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
| A. | 反应容器内压强不随时间变化而变化 | |
| B. | 反应器内P、Q、R、S四种气体共存 | |
| C. | 生成P的速率与生成S的速率相等 | |
| D. | 生成1mol P必有1molQ生成 |