题目内容
我国某大型电解铜生产企业,其冶炼工艺中铜、硫回收率达到97%、87%.下图表示其冶炼加工的流程:
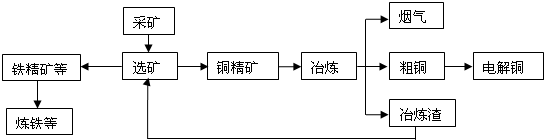
冶炼中的主要反应:Cu2S+O2
2Cu+SO2
(1)烟气中的主要废气是 ,从提高资源利用率和减排考虑,其综合利用方式是: .
(2)电解法精炼铜时,阳极是 (填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单质的形式沉淀在电解槽 (填“阳极”或“阴极”)的槽底,阴极的电极反应式是 .
(3)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解.
几种物质的溶度积常数(Ksp)
①调节电解液的pH是除去杂质离子的常用方法.根据上表中溶度积数据判断,含有等物质的量浓度Fe2+、
Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是 .
②一种方案是先加入过量的H2O2,再调节pH到4左右,加入H2O2的目的是 .加入H2O2后发生反应的离子方程式为 .

冶炼中的主要反应:Cu2S+O2
| ||
(1)烟气中的主要废气是
(2)电解法精炼铜时,阳极是
(3)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解.
几种物质的溶度积常数(Ksp)
| 物 质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是
②一种方案是先加入过量的H2O2,再调节pH到4左右,加入H2O2的目的是
考点:物质分离和提纯的方法和基本操作综合应用,难溶电解质的溶解平衡及沉淀转化的本质,电解原理
专题:实验设计题,电化学专题
分析:(1)根据反应原理Cu2S+O2
2Cu+SO2分析烟气中的主要废气成分;可以利用二氧化硫制取硫酸;
(2)根据电解原理分析电解精炼铜的阳极材料;根据粗铜所在的电极分析;根据电解槽中阴极得到电子发生还原反应写出阴极的电极反应;
(3)①根据溶度积越大溶解度越大,随pH升高最先沉淀的是对应强氧化物的溶度积最小的离子分析;
②加入双氧水能够将亚铁离子氧化成铁离子,据此写出反应的离子方程式.
| ||
(2)根据电解原理分析电解精炼铜的阳极材料;根据粗铜所在的电极分析;根据电解槽中阴极得到电子发生还原反应写出阴极的电极反应;
(3)①根据溶度积越大溶解度越大,随pH升高最先沉淀的是对应强氧化物的溶度积最小的离子分析;
②加入双氧水能够将亚铁离子氧化成铁离子,据此写出反应的离子方程式.
解答:
解:(1)冶炼中的主要反应为:Cu2S+O2
2Cu+SO2,所以烟气的主要成分为二氧化硫;工业上可以将二氧化硫氧化成三氧化硫制取硫酸;
故答案为:SO2; 制硫酸;
(2)电解法炼铜时,阳极发生氧化反应、阴极发生还原反应,所以阳极为粗铜板,粗铜板中的金、银还原性比铜的弱,反应后以单质的形式在电解槽阳极的槽底,在电解槽的阴极铜离子得到电子生成金属铜,该电极反应为:Cu2++2e-═Cu,
故答案为:粗铜板; 阳极; Cu2++2e-═Cu;
(3)①根据表中氢氧化物的溶度积可知,氢氧化铁的溶度积最小,其溶解度最小,所以随pH升高最先沉淀下来的离子是铁离子;
故答案为:Fe3+;
②双氧水能够将溶液中的亚铁离子氧化成铁离子,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:将Fe2+氧化为Fe3+; 2Fe2++H2O2+2H+═2Fe3++2H2O.
| ||
故答案为:SO2; 制硫酸;
(2)电解法炼铜时,阳极发生氧化反应、阴极发生还原反应,所以阳极为粗铜板,粗铜板中的金、银还原性比铜的弱,反应后以单质的形式在电解槽阳极的槽底,在电解槽的阴极铜离子得到电子生成金属铜,该电极反应为:Cu2++2e-═Cu,
故答案为:粗铜板; 阳极; Cu2++2e-═Cu;
(3)①根据表中氢氧化物的溶度积可知,氢氧化铁的溶度积最小,其溶解度最小,所以随pH升高最先沉淀下来的离子是铁离子;
故答案为:Fe3+;
②双氧水能够将溶液中的亚铁离子氧化成铁离子,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:将Fe2+氧化为Fe3+; 2Fe2++H2O2+2H+═2Fe3++2H2O.
点评:本题主要考查了工业电解冶炼金属铜原理、物质的分离和提纯、离子方程的书写,题目难度中等,注意掌握电解原理、物质的分离和提纯方法,试题培养了学生的分析、理解能力和实验设计能力.

练习册系列答案
相关题目
胶体区别于与其它分散系的本质特征是( )
| A、胶体粒子直径在1-100nm之间 |
| B、均一、稳定、透明 |
| C、有丁达尔效应 |
| D、胶体分散质能透过滤纸 |
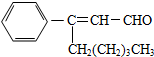 茉莉醛具有浓郁的茉莉花香,其结构简式如图所示,关于茉莉醛的下列叙述正确的是( )
茉莉醛具有浓郁的茉莉花香,其结构简式如图所示,关于茉莉醛的下列叙述正确的是( )| A、茉莉醛与苯甲醛互为同系物 |
| B、在加热和催化剂作用下加氢,每摩尔茉莉醛最多能消耗2mol氢气 |
| C、一定条件下,茉莉醛能被银氨溶液、新制氢氧化铜等多种氧化剂氧化 |
| D、从理论上说,202g茉莉醛能从足量银氨溶液中还原出216g银 |
实验室用固态不纯氯化钠(含少量泥沙和Na2SO4杂质)制取纯净氯化钠溶液.下列操作可供选用:①逐滴加入稀盐酸至稍过量;②煮沸;③加蒸馏水溶解;④过滤 ⑤加入稍过量的Na2CO3溶液;⑥加入稍过量的BaCl2溶液.上述实验操作的正确顺序应是( )
| A、①②③④⑤⑥ |
| B、④③⑥⑤①② |
| C、③⑥⑤④①② |
| D、③⑥⑤①④② |

 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.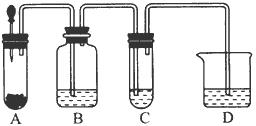 小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)
小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)