题目内容
4.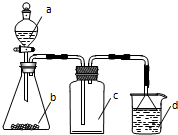 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质能完成相关实验的是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质能完成相关实验的是( )| 选项 | a中物质 | b中物质 | c中的气体 | d中物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 稀硝酸 | Cu | NO | H2O |
| C | 硫酸 | Na2CO3 | CO2 | NaOH溶液 |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据装置图可知所制备的气体应为固体和液体不加热制备,并用向上排空气法收集以及采用防倒吸的方法进行尾气处理,根据各选项中反应物的状态判断发生装置、气体的性质以及是否除杂等角度解答本题.
解答 解:A、氨气的密度比空气小,c装置中应该短管进,长管出,故A错误;
B、铜与稀硝酸反应产生的气体为NO,NO不能用排空气法收集,水不能完全吸收,故B错误;
C、硫酸可以与碳酸钠反应,生成二氧化碳,CO2气体的密度比空气大,c装置中应该长管进,短管出,剩余二氧化碳气体可以用氢氧化钠溶液吸收尾气,装置符合制备、收集和吸收的要求,故C正确;
D、浓盐酸与MnO2制氯气需要加热,且由于浓盐酸易挥发,所以c中收集的气体不纯净,应该在bc之间应添加除去氯化氢的装置,剩余其用氢氧化钠溶液吸收,故D错误;
故选C.
点评 本题考查化学实验基本原理(气体的制备),实验装置、仪器的使用,题目难度不大,掌握物质的性质即可解答.

练习册系列答案
相关题目
12.能影响水的电离平衡,最终使水电离的离子在溶液中表现为c(OH-)<c(H+)的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中通入二氧化碳气体 | D. | 向水中加醋酸钠晶体 |
19.硼(B)元素有2种天然核素:10B和11B,又知硼(B)元素的平均相对原子质量为10.8,则硼元素中11B的物质的量分数是( )
| A. | 20% | B. | 略大于20% | C. | 略小于20% | D. | 80% |
16.下列实验操作可以达到实验目的是( )
| 实 验目的 | 实验操作 | |
| A. | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体直接通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B. | 除去溴水中的少量溴化钠 | 加入乙醇,震荡,静置,分液,取出上层液体 |
| C. | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液,取出上层液体 |
| D. | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
13.A、B、C三种强电解质,它们在水中电离出的离子如表所示
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中C电极质量增加了54克.常温下各烧杯中溶液的pH与电解时间t的关系图如下.据此回答下列问题
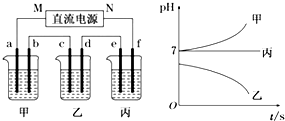
(1)N为电源的正极
(2)计算电极f上生成的气体在标准状况下的体积2.8L.
(3)写出乙烧杯中发生反应的化学方程式4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3.
(4)若电解后甲溶液的体积为5 L,则该溶液的pH为13.
(5)要使丙恢复到原来的状态,应加入4.5 gH2O.(填写化学式)
| 阳离子 | Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |

(1)N为电源的正极
(2)计算电极f上生成的气体在标准状况下的体积2.8L.
(3)写出乙烧杯中发生反应的化学方程式4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3.
(4)若电解后甲溶液的体积为5 L,则该溶液的pH为13.
(5)要使丙恢复到原来的状态,应加入4.5 gH2O.(填写化学式)
14.低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为2NH3(g)+NO(g)+NO2(g)$→_{催化剂}^{150℃}$2N2(g)+3H2O(g)△H<0,在恒容的密闭容器中,下列有关说法不正确的是( )
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率增大 | |
| C. | 单位时间内消耗NO和N2的物质的量比为1:1时,反应达到平衡 | |
| D. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率不变 |