题目内容
联合国气候变化大会2009年12月7日在丹麦首都哥本哈根拉开帷幕,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.工业上有一种方法是用CO2来生产燃料甲醇,298.15K时,CO2、H2、与CH3OH、H2O的平均能量与合成甲醇反应的活化能的曲线图如图1所示,据图回答问题:
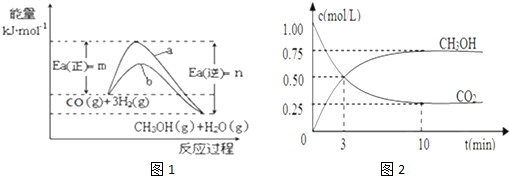
(1)写出合成甲醇反应的热化学方程式 ;
(2)在图中曲线 (填“a”或“b”)表示加入催化剂的能量变化曲线.
(3)在体积为l L的密闭容器中,充入lmolCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L?min).
②该反应的平衡常数为 ,升高温度,K值 (填“增大”、“减小”或“不变”).
③下列措施中能使
增大的是 .
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1mol CO2和3mol H2
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2═2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应式为: .
有人提出,可以设计反应2CO═2C+O2(△H>0、△S<0)来消除CO的污染.请你判断是否可行并说出理由: .

(1)写出合成甲醇反应的热化学方程式
(2)在图中曲线
(3)在体积为l L的密闭容器中,充入lmolCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②该反应的平衡常数为
③下列措施中能使
| n(CH3OH) |
| n(CO2) |
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1mol CO2和3mol H2
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2═2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应式为:
有人提出,可以设计反应2CO═2C+O2(△H>0、△S<0)来消除CO的污染.请你判断是否可行并说出理由:
考点:化学平衡的影响因素,热化学方程式,化学电源新型电池
专题:基本概念与基本理论
分析:(1)根据能量守恒计算出反应热,再根据热化学方程式的书写解答;
(2)使用催化剂改变反应历程,降低该反应的活化能,提高活化分子的百分数,化学反应速率加快,不影响反应热;
(3)①根据图表用三段式解题法计算出平衡时反应混合物各组分的浓度,根据v=
计算v(H2);
②代入该反应的平衡常数为k=
计算平衡常数,正反应放热,升温时平衡逆向移动,K减小;
③在反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)中,使
增大,只要使平衡正向移动,且甲醇增多、二氧化碳减少即可;
(4)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式;根据△G的大小判断反应能否进行.
(2)使用催化剂改变反应历程,降低该反应的活化能,提高活化分子的百分数,化学反应速率加快,不影响反应热;
(3)①根据图表用三段式解题法计算出平衡时反应混合物各组分的浓度,根据v=
| △c |
| △t |
②代入该反应的平衡常数为k=
| [H2O]?[CH3OH] |
| [CO2]?[H2]3 |
③在反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)中,使
| n(CH3OH) |
| n(CO2) |
(4)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式;根据△G的大小判断反应能否进行.
解答:
解:(1)由图可知,反应热△H=-(n-m) kJ?mol-1,热化学反应方程式为CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-(n-m) kJ?mol-1,
故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-(n-m) kJ?mol-1;
(2)催化剂改变反应历程,降低该反应的活化能,反应热取决于反应物与生成物的总能量,与途径无关,不影响反应热,所以b线表示使用催化剂;催化剂改变反应历程,降低该反应的活化能,提高活化分子的百分数,化学反应速率加快,
故答案为:b;
(3)①利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
=0.075 mol?L-1?min-1,反应速率之比等于化学计量数之比,v(H2)=3×0.075mol/(L?min)=0.225mol/(L?min),故答案为:0.225mol/(L?min);
②平衡常数为k=
=
=5.33;正反应放热,升温时平衡逆向移动,K减小,故答案为:5.33;减小;
③在反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)中,使
增大,只要使平衡正向移动,且甲醇增多、二氧化碳减少即可,
A、升高温度,平衡向吸热的逆向移动,使
减小,故A错误;
B、充入He(g),使体系压强增大,各气体分压不变,平衡不移动,故B错误;
C、将水从体系中分离,平衡正向移动且使
增大,故C正确;
D、再充入1mol CO2和3mol H2,导致容器中压强增大,平衡正向移动,使
增大,故D正确;
故选CD;
(4)总反应式为2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式,所以阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,反应2CO=2C+O2(△H>0、△S<0),则△G=△H-T?△S>0,反应是一个焓增、熵减的反应,任何情况下不能自发进行;
故答案为:2CO2+4e-+2H2O=2CO+4OH-;不可行,该反应是一个焓增、熵减的反应,任何情况下不能自发进行.
故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-(n-m) kJ?mol-1;
(2)催化剂改变反应历程,降低该反应的活化能,反应热取决于反应物与生成物的总能量,与途径无关,不影响反应热,所以b线表示使用催化剂;催化剂改变反应历程,降低该反应的活化能,提高活化分子的百分数,化学反应速率加快,
故答案为:b;
(3)①利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
| 0.75mol/L |
| 10min |
②平衡常数为k=
| [H2O]?[CH3OH] |
| [CO2]?[H2]3 |
| 16 |
| 3 |
③在反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)中,使
| n(CH3OH) |
| n(CO2) |
A、升高温度,平衡向吸热的逆向移动,使
| n(CH3OH) |
| n(CO2) |
B、充入He(g),使体系压强增大,各气体分压不变,平衡不移动,故B错误;
C、将水从体系中分离,平衡正向移动且使
| n(CH3OH) |
| n(CO2) |
D、再充入1mol CO2和3mol H2,导致容器中压强增大,平衡正向移动,使
| n(CH3OH) |
| n(CO2) |
故选CD;
(4)总反应式为2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式,所以阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,反应2CO=2C+O2(△H>0、△S<0),则△G=△H-T?△S>0,反应是一个焓增、熵减的反应,任何情况下不能自发进行;
故答案为:2CO2+4e-+2H2O=2CO+4OH-;不可行,该反应是一个焓增、熵减的反应,任何情况下不能自发进行.
点评:本题考查较为综合,涉及反应速率、平衡常数、平衡移动以及电化学等知识,题目难度中等,注意把握影响平衡移动的因素以及平衡移动方向的判断.

练习册系列答案
相关题目
用①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液 鉴别以下三种化合物的一组试剂是( )


| A、②与③ | B、③与④ |
| C、①与④ | D、①与② |
下列性质比较不正确的是( )
| A、离子半径:Al3+<Mg2+<F- |
| B、酸性:H2SiO3<H3PO4<H2SO4<HClO4 |
| C、热稳定性:HI>HBr>HCl>HF |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
在不同条件下,分别测得反应2SO2+O2?2SO3的速率如下,其中最快的是( )
| A、v(SO3)=4 mol?L-1?min-1 |
| B、v(O2)=2 mol?L-1?min-1 |
| C、v(SO2)=5 mol?L-1?min-1 |
| D、v(SO2)=0.1 mol?L-1?S-1 |
以下各种表示式中,最能反映氮原子核外电子运动状态的是( )
A、 |
B、 |
| C、1s22s22p3 |
D、 |