题目内容
5. 如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )
如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )| A. | 往Ca(OH)2和KOH的混合溶液中通入CO2 | |
| B. | 往AlCl3和NH4Cl的混合溶液中加NaOH溶液 | |
| C. | 往Al2(SO4)3和(NH4)2SO4的混合溶液中加Ba(OH)2溶液 | |
| D. | 往NH4Al(SO4)2溶液中加入NaOH溶液 |
分析 A、向KOH和Ca(OH)2的混合稀溶液中通入CO2,先二氧化碳和氢氧化钙反应生成碳酸钙沉淀,当氢氧化钙消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钾反应生成碳酸钾,当氢氧化钾完全反应后,继续通入二氧化碳,二氧化碳和碳酸钙、水反应生成可溶性的碳酸氢钙,当硅酸钙反应后,继续通入二氧化碳,二氧化碳和碳酸钾反应生成碳酸氢钾;
B、往AlCl3和NH4Cl的混合溶液中加NaOH溶液,开始生成沉淀到最大量和沉淀最大量到沉淀完全消失,需氢氧化钠的物质的量之比为3:1;
C、最终沉淀量不可能完全消失,有硫酸钡沉淀;
D、开始生成沉淀到最大量和沉淀最大量到沉淀完全消失,需氢氧化钠的物质的量之比为3:1.
解答 解:A、向KOH和Ca(OH)2的混合稀溶液中通入CO2,先二氧化碳和氢氧化钙反应生成碳酸钙沉淀,沉淀量逐渐增加,当氢氧化钙消耗完时,沉淀量最大,继续通入二氧化碳,二氧化碳和氢氧化钾反应生成碳酸钾,沉淀量不变,当氢氧化钾完全反应后,继续通入二氧化碳,二氧化碳和碳酸钙、水反应生成可溶性的碳酸氢钙,醋酸钙的量逐渐减少直至完全消失,当碳酸钙反应后,继续通入二氧化碳,二氧化碳和碳酸钾反应生成碳酸氢钾,故A正确;
B、往AlCl3和NH4Cl的混合溶液中加NaOH溶液,开始生成沉淀到最大量和沉淀最大量到沉淀完全消失,需氢氧化钠的物质的量之比为3:1,故B错误;
C、最终沉淀量不可能完全消失,有硫酸钡沉淀,与图象不符合,故C错误;
D、开始生成沉淀到最大量和沉淀最大量到沉淀完全消失,需氢氧化钠的物质的量之比为3:1,与图象不符合,故D错误;
故选A.
点评 本题考查物质之间的反应,明确物质的性质、及反应先后顺序是解本题关键,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

下列说法中正确的是( )

下列说法中正确的是( )
| A. | 1mol N2(g)和1 mol O2(g)完全反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
13.已知33As、35Br位于同一周期,下列关系不正确的是( )
| A. | 还原性:As3->Br->Cl- | B. | 熔点:As>Br2>Cl2 | ||
| C. | 原子半径:As>Br>Cl | D. | 酸性:HCl>HBr>AsH3 |
20.酸化是化学实验室中常用的操作之一,下列酸化处理正确的是( )
| A. | 检验CH3CH2Cl碱性水解产生的Cl-,先要用稀硫酸酸化,再检验 | |
| B. | KMnO4溶液通常可用盐酸酸化,以增强氧化性 | |
| C. | 配置Fe(NO3)2溶液时,用硝酸酸化,可抑制水解 | |
| D. | 鉴别溶液中是否有SO42-,先用盐酸酸化,再加BaCl2溶液 |
10.KAl(SO4)2、KFe(SO4)2、(NH4)Fe(SO4)2都属于复盐,通过类比判断,下列属于复盐的是( )
| A. | NaAlO2 | B. | KMgCl3 | C. | CaOCl2 | D. | Na3AlF6 |
17.常温下用 a L pH=3的HX溶液与 b L pH=11的氢氧化钠溶液相混合,下列叙述正确的是( )
| A. | 若二者恰好中和,则一定是 a=b | B. | 若混合液显碱性,则一定是 b≥a | ||
| C. | 若混合液显中性,则一定是 a≤b | D. | 若混合液显酸性,则一定是 a>b |
14.下列化学用语正确的是( )
| A. | Na-O-H与 都表示氢氧化钠 都表示氢氧化钠 | B. |  与 与 都表示氟离子 都表示氟离子 | ||
| C. | -OH与 都表示羟基 都表示羟基 | D. |  与 与 都表示水分子 都表示水分子 |
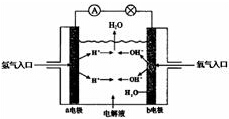 某种氢氧燃料电池的电解液为K0H溶液,该燃料电池的总反应方程式为:2H2+O2═2H2O.完成下列问题.
某种氢氧燃料电池的电解液为K0H溶液,该燃料电池的总反应方程式为:2H2+O2═2H2O.完成下列问题.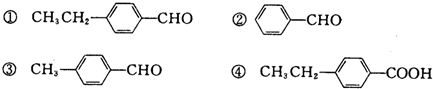
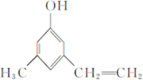 .
.