题目内容
14.下列电离方程式正确的是( )| A. | CuSO4═Cu+2+SO4-2 | B. | NH4NO3═NH4++NO3- | ||
| C. | Na2CO3═Na2++CO32- | D. | KClO3═K++Cl-+3O2- |
分析 A.硫酸铜为强电解质,能完全电离出铜离子和硫酸根离子,阴阳离子符号书写错误;
B.硝酸铵为强电解质,能完全电离出铵根离子和硝酸根离子,电离方程式书写正确;
C.碳酸钠为强电解质,能完全电离出钠离子和碳酸根离子,钠离子脚标应转化成化学计量数;
D.氯酸钾为强电解质,能完全电离出钾离子和氯酸根离子,氯酸根离子书写错误.
解答 解:A.硫酸铜为强电解质,能完全电离,电离方程式中阴阳离子符号书写错误,正确的电离方程式为:CuSO4═Cu2++SO42-,故A错误;
B.硝酸铵为强电解质,能完全电离,电离方程式为:NH4NO3═NH4++NO3-,故B正确;
C.碳酸钠为强电解质,能完全电离,电离方程式中钠离子脚标应转化成化学计量数2,正确的电离方程式为:Na2CO3═2Na++CO32-,故C错误;
D.氯酸钾为强电解质,能完全电离,电离方程式中氯酸根离子不能拆写,正确的电离方程式为:KClO3═K++ClO3-,故D错误;
故选B.
点评 本题考查了电离方程式的书写,掌握正确书写电离方程式的方法是解答本题的关键,注意电荷守恒和质量守恒定律、原子团、弱酸的酸根离子等,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.在一定温度下,向一个密闭的定容容器中,通入SO2、O2及合适催化剂,使之发生反应,2SO2(g)+O2(g)$\frac{\underline{\;催化剂\;}}{\;}$2SO3(g)△H=-196.6kJ•mol-1.回答下列问题:
(1)下列描述中能说明反应已达平衡状态的标志是BD.
A.v(O2)正=2v(SO3)逆
B.容器中混合气体的平均摩尔质量不再变化
C.容器中混合气体的密度不再变化
D.容器中混合气体的分子总数不再变化
(2)若在1L容器中通入3mol SO2和2mol O2,达到平衡时容器内气体压强为起始时的90%,则平衡时SO3的体积分数为22.2%,放出的热量为98.3kJkJ.该温度下的平衡常数为0.17.
(3)某定容容器中反应情况如下表:
根据表中数据比较:①温度:T1<T2(填“>”、“<”或“=”,下同).
②SO3体积分数:ω2>ω1
(4)若该反应在恒压容器中进行,到达平衡后充入Ar气(不参与反应),则反应再次达到平衡时SO2浓度减小,转化率减小(填“增大”、“减小”或“不变”).
(1)下列描述中能说明反应已达平衡状态的标志是BD.
A.v(O2)正=2v(SO3)逆
B.容器中混合气体的平均摩尔质量不再变化
C.容器中混合气体的密度不再变化
D.容器中混合气体的分子总数不再变化
(2)若在1L容器中通入3mol SO2和2mol O2,达到平衡时容器内气体压强为起始时的90%,则平衡时SO3的体积分数为22.2%,放出的热量为98.3kJkJ.该温度下的平衡常数为0.17.
(3)某定容容器中反应情况如下表:
| 温度(℃) | SO2起始浓度(mol•L-1) | O2起始浓度(mol•L-1) | 平衡时SO3 体积分数(%) |
| T1 | 2 | 1 | ω1 |
| T1 | 4 | 2 | ω2 |
| T2 | 4 | 2 | ω1 |
②SO3体积分数:ω2>ω1
(4)若该反应在恒压容器中进行,到达平衡后充入Ar气(不参与反应),则反应再次达到平衡时SO2浓度减小,转化率减小(填“增大”、“减小”或“不变”).
5.在同温同压下,下列各组热化学方程式中,△H1>△H2的是( )
| A. | 2H2(g)+O2(g)=2H2O(l)△H1 2H2(g)+O2(g)=2H2O(g)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1 S(s)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+O2(g)=CO(g)△H1 C(s)+O2(g)=CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
2.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 23gNa一定条件下与足量的O2反应转移的电子数一定为NA | |
| B. | 标准状态下,2.24LCCl4中的分子数目为0.1NA | |
| C. | 1L1 mol/L饱和FeCl3溶液滴入沸水中完全水解生成NA个氢氧化铁胶体粒子 | |
| D. | 0.1 mol•L-1 氢氧化钠溶液中所含钠离子数为0.1NA |
9.一定温度下,可逆反应3X(g)+Y(g)?2Z(g)达到化学平衡状态的标志是( )
| A. | 单位时间内生成3n mol X,同时消耗n mol Y | |
| B. | X的生成速率与Z的消耗速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | X、Y、Z的物质的量之比为3:1:2 |
19.下列操作不能说明仪器组装气密性良好的是( )
| A. |  | B. |  | C. |  | D. |  |
6.下列有关表述中正确的是( )
| A. | 氧化铁的化学式:FeO | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 | |
| D. | 质子数为53,中子数为78的碘原子表示为:${\;}_{53}^{131}$I |


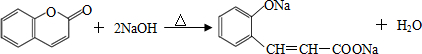 .
. 、
、 、
、 (其中三种).
(其中三种). 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 .
.