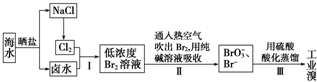
题目内容
17.1molM(表示金属单质)溶于某种浓度的硝酸中,生成dmolM2+、fmolM3+、gmolNO、hmolNO2,下列有关叙述中,不正确的是( )| A. | 反应中生成(2g+h)molH2O | B. | 2d+3f=3g+h | ||
| C. | 2<3g+h<3 | D. | h随着d增大而增大 |
分析 浓硝酸与金属反应生成二氧化氮,稀硝酸与金属单质反应生成一氧化氮,氧化还原反应中氧化剂得到电子总数等于还原剂生气电子总数,依据得失电子守恒可知单质1molM生成dmolM2+、fmolM3+,失去电子总数等于硝酸还原为gmolNO、hmolNO2,得到电子总数,结合原子个数守恒分析解答.
解答 解:A.依据硝酸中氢原子与氮原子个数相等,则1mol硝酸含有1mol氮原子,二氧化氮、一氧化氮原子所含氮原子等于水中氢原子总数,即生成水(2g+h)molH2O,故A正确;
B.依据得失电子守恒金属M失去电子总数:d×2+f×3,硝酸得到电子总数:g×3+h×1,则2d+3f=3g+h,故B正确;
C.极值法,硝酸生成gmolNO、hmolNO2得到电子总数:g×3+h×1,若1molM全部生成三价离子,则失去3mol电子,若1molM全部生成二价离子,则失去2mol电子,依据得失电子守恒则:2<g×3+h×1<3,故C正确;
D.硝酸浓度越大氧化性越强,则氧化产物为M3+,还原产物为二氧化氮,所以h随着f增大而增大,故D错误;
故选:D.
点评 本题考查了浓硝酸与金属的反应,明确硝酸的氧化性随着浓度增大而增大是解题关键,注意氧化还原反应得失电子守恒规律及极值法应用,题目难度中等.

练习册系列答案
相关题目
8.下列化合物中,既存在离子键又存在共价键的是( )
| A. | 氢氧化钠 | B. | 乙醇 | C. | 氯化钾 | D. | 过氧化钠 |
5.用配制好的淀粉溶液进行下列实验,得不到预期实验现象的是( )
| A. | 用聚光手电筒照射,产生丁达尔效应 | |
| B. | 加入碘水,溶液变蓝 | |
| C. | 加入稀硫酸振荡并加热,再加入新制Cu(OH)2悬浊液,有红色沉淀生成 | |
| D. | 加入碘化钾溶液后,无明显现象 |
10.某元素的一种同位素原子${\;}_{Z}^{A}$X,它与3H原子组成HmX分子,在agHmX中所含中子的物质的量是( )
| A. | $\frac{a}{A}$(A-Z+2m)mol | B. | $\frac{a}{A}$(A+2m)mol | C. | $\frac{a}{A+m}$(A-Z+3m)mol | D. | $\frac{a}{A+3m}$ (A-Z+2m)mol |
8.某烃的结构简式为: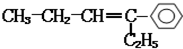 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
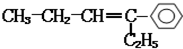 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )| A. | 4,3,10 | B. | 4,3,12 | C. | 4,2,7 | D. | 4,5,10 |
 A是在人们日常生活中最常见的有机物,75%(体积分数)的水溶液可用于医疗消毒,B是一种植物生长调节剂,通常情况下C是一种具有果香味的无色液体.
A是在人们日常生活中最常见的有机物,75%(体积分数)的水溶液可用于医疗消毒,B是一种植物生长调节剂,通常情况下C是一种具有果香味的无色液体. 如图是一套实验室制气装置,某课外活动小组欲利用这套装置快速制取氧气和氯化氢气体,供选用的试剂有:A.浓H2SO4,B.浓盐酸,C.食盐,D.MnO2,?E.H2O2(aq)?,F.KClO3,G.KMnO4溶液,试完成下列问题:
如图是一套实验室制气装置,某课外活动小组欲利用这套装置快速制取氧气和氯化氢气体,供选用的试剂有:A.浓H2SO4,B.浓盐酸,C.食盐,D.MnO2,?E.H2O2(aq)?,F.KClO3,G.KMnO4溶液,试完成下列问题: