题目内容
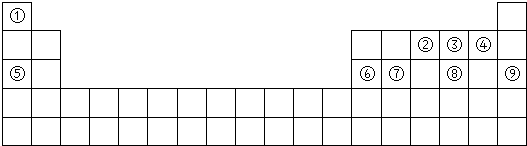
15.下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)在①~⑨元素中,金属性最强的元素是Na,氧化物有两性的元素是Al.(均填元素符号)
(2)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是b
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
设计一个简单实验,证明元素⑦与元素⑧的非金属性强弱,只写出反应的化学方程式(不写实验步骤)Cl2+Na2S=2 NaCl+S↓
(3)⑤与⑥两元素最高价氧化物的水化物相互反应的离子方程式为_Al(OH)3+OH-=AlO2-+2H2O.
(4)③的氢化物的电子式为

(5)①④⑤三种元素形成的最简单一种化合物含有的化学键类型有离子键、共价键.
(6)⑤⑦④原子半径由大到小的顺序是Na>S>O,三种原子分别形成简单离子后,离子半径由大到小的顺序是S2->O2->Na+
(7)⑦与第四周期同族元素的原子序数之差为18.
分析 由元素在周期表中位置可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强;氧化铝属于两性氧化物;
(2)根据单质与氢气反应的难易程度、剧烈程度判断,根据氢化物稳定性、最高价含氧酸的酸性、单质之间的相互置换、化合物中元素化合价等判断非金属性强弱;
(3)⑤的最高价氧化物对应的水化物为NaOH,⑥的最高价氧化物为氧化铝,二者反应生成偏铝酸钠与水;
(4)③元素的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;
(5)①、④、⑤三种元素组成化合物为NaOH;
(6)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(7)⑦与第四周期同族元素的原子序数之差为第四周容纳元素种数.
解答 解:由元素在周期表中位置可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,上述元素中Na的金属性最强,Al元素氧化物--氧化铝属于两性氧化物,故答案为:Na;Al;
(2)a.单质状态属于物理性质,不能比较非金属性强弱,故a错误;
b.⑧的氢化物比⑦的氢化物稳定,说明⑧的非金属性更强,故b正确;
c.单质与氢氧化钠溶液反应不能比较非金属性强弱,故c错误;
d.不是最高氧化物对应水化物的酸性强弱比较,不能说明元素非金属性强弱,故d错误;
根可以利用单质之间的相互置换进行验证,相应方程式为:Cl2+Na2S=2 NaCl+S↓,
故答案为:b;Cl2+Na2S=2 NaCl+S↓;
(3)⑤与⑥两元素最高价氧化物的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,反应方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)③的氢化物为NH3,电子式为 ,故答案为:
,故答案为: ;
;
(5)①、④、⑤三种元素组成化合物为NaOH,含有离子键、共价键,
故答案为:离子键、共价键;
(6)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>S>O,
离子电子层结构相同,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->O2->Na+,
故答案为:Na>S>O;S2->O2->Na+;
(7)⑦与第四周期同族元素的原子序数之差为第四周容纳元素种数,即原子序数相差18,
故答案为:18.
点评 本题考查元素周期表与元素周期律综合应用,难度不大,注意掌握金属性、非金属性强弱比较实验事实,掌握微粒半径比较规律.

| A. | HF、NH3、CO、H2S | B. | NO、SO2、CCl4、H2O2 | ||
| C. | SO3、H2O、N2、SiF4 | D. | CO、BF3、CS2、PCl3 |
| A. | 用聚光手电筒照射,产生丁达尔效应 | |
| B. | 加入碘水,溶液变蓝 | |
| C. | 加入稀硫酸振荡并加热,再加入新制Cu(OH)2悬浊液,有红色沉淀生成 | |
| D. | 加入碘化钾溶液后,无明显现象 |
| A. | $\frac{a}{A}$(A-Z+2m)mol | B. | $\frac{a}{A}$(A+2m)mol | C. | $\frac{a}{A+m}$(A-Z+3m)mol | D. | $\frac{a}{A+3m}$ (A-Z+2m)mol |
 如图是一套实验室制气装置,某课外活动小组欲利用这套装置快速制取氧气和氯化氢气体,供选用的试剂有:A.浓H2SO4,B.浓盐酸,C.食盐,D.MnO2,?E.H2O2(aq)?,F.KClO3,G.KMnO4溶液,试完成下列问题:
如图是一套实验室制气装置,某课外活动小组欲利用这套装置快速制取氧气和氯化氢气体,供选用的试剂有:A.浓H2SO4,B.浓盐酸,C.食盐,D.MnO2,?E.H2O2(aq)?,F.KClO3,G.KMnO4溶液,试完成下列问题:
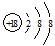
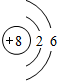 ,B的离子结构示意图
,B的离子结构示意图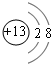 ,D的单质分子的电子式
,D的单质分子的电子式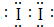 .
.