题目内容
5.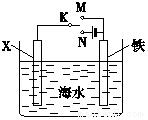 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护.(1)若X为碳棒,为减缓铁的腐蚀,开关K应该置于N处.此时铁电极的电极反应式为2H++2e-=H2↑.
(2)若X为锌,开关K置于M处,该电化学防护法称为牺牲阳极的阴极保护法.此时铁电极的电极反应式为O2+4e-+2H2O=4OH-.
分析 (1)若K为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe连接电源的负极;
(2)若K为锌,开关K置于a处,Zn为阳极被腐蚀,Fe为阴极被保护.
解答 解:(1)若X为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe为电解池的阴极,电极反应为:2H++2e-=H2↑,故K连接N处,故答案为:N;2H++2e-=H2↑;
(2)若X为锌,开关K置于M处,Zn为负极被腐蚀,Fe为正极被保护,该防护法称为牺牲阳极的阴极保护法,正极反应为:O2+4e-+2H2O=4OH-,故答案为:牺牲阳极的阴极保护法;O2+4e-+2H2O=4OH-.
点评 本题考查了金属的腐蚀和防护原理,根据原电池中正负极上得失电子及电极反应式来分析解答即可,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.溶解了三种正盐的混合溶液中含有0.2molNa+、0.25molMg2+,0.4molCl-,则还含有的另一种离子SO42-为( )
| A. | 0.15mol | B. | 0.3mol | C. | 0.05mol | D. | 无法计算 |
10.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| B. | 23g Na 与足量H2O反应完全后可生成NA个H2分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
17.下列实验操作正确的是( )
| A. | 向盛水的烧杯中投入小拇指头大小的钠块,观察现象 | |
| B. | 将一小块钠放在石棉网上加热,观察现象 | |
| C. | 实验后剩余的钠不能放回原瓶 | |
| D. | 用手掰开一块金属钠,观察钠的颜色 |
14.在t℃时,将a gNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg/cm3,质量分数为w,其中含NH4+的物质的量为b mol.下列叙述中正确的是( )
| A. | 溶质的质量分数w=$\frac{1000a}{17V}$100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ (mol/L) | |
| C. | 溶液中c(OH-)=$\frac{b}{V}$ (mol/L) | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w |
15.元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( )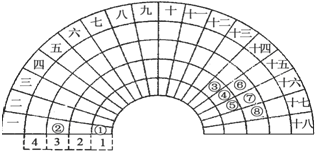

| A. | ③元素形成的单质晶体均属于原子晶体 | |
| B. | ④元素的气态氢化物易液化,是因为其分子间存在氢键 | |
| C. | ②、⑦、⑧对应的简单离子半径依次减小 | |
| D. | ②⑤⑦三种元素形成的盐溶液在25℃时的pH值为7 |
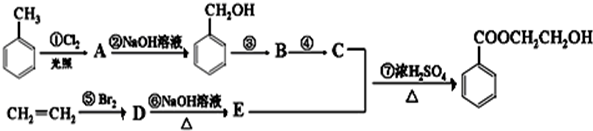
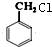 .
.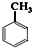 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$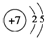 ;
;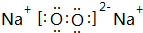 ;
;