题目内容
20.在实验室里,某同学取一小块金属钠,做钠与水反应的实验.完成下列问题:(1)切开的金属钠暴露在空气中,最先观察到的属于发生化学变化的现象是钠块表面由银白色变为暗灰色(或钠块表面变暗),所发生反应的化学方程式是4Na+O2═2Na2O.
(2)将钠投入水中后,钠融化成一个小球,根据这一现象你能得出的结论是
①钠与水反应放出热量,②钠的熔点低.
(3)将一小块钠投入盛有CuSO4溶液的烧杯中,不可能观察到的现象是C(填序号)
A.有气体生成 B.钠融化成小球并在液面上游动
C.溶液底部有银白色的金属钙生成 D.溶液中有蓝色浑浊
(4)钠与CuSO4溶液反应的化学方程式为:(用一个化学方程式表示)2Na+2H2O+CuSO4═H2↑+Cu(OH)2↓+Na2SO4.
分析 (1)钠暴露在空气中和氧气反应生成氧化钠而变暗;
(2)钠熔成小球,说明钠和水放出的热量使钠熔化;钠的密度小于水,钠的熔点较低;
(3)钠的密度比水小,熔点低,将一小块钠投入到硫酸铜溶液中,钠先和水反应生成NaOH和氢气,生成的NaOH和CuSO4反应生成蓝色沉淀Cu(OH)2;
(4)钠先和水反应生成NaOH和氢气,生成的NaOH和CuSO4反应生成沉淀Cu(OH)2,据此分析.
解答 解:(1)钠放置在空气中和氧气反应生成氧化钠而变暗,反应方程式为:4Na+O2═2Na2O,
故答案为:钠块表面由银白色变为暗灰色(或钠块表面变暗);4Na+O2═2Na2O;
(2)钠熔成小球,说明钠和水放出的热量使钠熔化,同时说明钠的熔点较低;故答案为:钠与水反应放出热量;钠的熔点低;
(3)A.钠和水反应生成氢气,所以有气体生成,故A不选;
B.钠的密度小于水的密度,所以会浮在水面上,钠和水反应放出大量的热,且钠的熔点较低,使钠熔成小球,钠和水反应生成的氢气使小球到处游动,故B不选;
C.钠和水反应生成氢氧化钠,氢氧化钠和硫酸铜反应生成蓝色氢氧化铜沉淀,故C选;
D.钠和水反应生成氢氧化钠,氢氧化钠和硫酸铜反应生成蓝色氢氧化铜沉淀,故D不选;
故选:C;
(4)钠先和水反应生成NaOH和氢气,生成的NaOH和CuSO4反应生成沉淀Cu(OH)2,化学方程式为:2Na+2H2O+CuSO4═H2↑+Cu(OH)2↓+Na2SO4,故答案为:2Na+2H2O+CuSO4═H2↑+Cu(OH)2↓+Na2SO4.
点评 本题考查了钠的性质,根据钠的物理性质和化学性质分析钠和水反应现象,注意钠与硫酸铜溶液的原理和相关方程式的书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.航天飞船可用肼(N2H4)和过氧化氢(H2O2)为动力源.已知1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量.下列说法中错误的是( )
| A. | 该反应中肼作还原剂 | |
| B. | 液态肼的燃烧热△H为-641.6kJ•mol-1 | |
| C. | 该动力源的突出优点之一是生成物对环境污染小 | |
| D. | 肼和过氧化氢反应的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6kJ•mol-1 |
8.关于HClO的分类错误的是( )
| A. | 含氧酸 | B. | 电解质 | C. | 酸性氧化物 | D. | 一元酸 |
15.将等质量的Na和Mg分别投入到足量的质量为m1g的水中和m2g的盐酸中,分别得到溶液a和b.若m1=m2,则a与b的质量关系为( )
| A. | 无法确定 | B. | a<b | C. | a=b | D. | a>b |
12.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液SO32-+2H+═SO2↑+H2O | |
| B. | CuSO4溶液与H2S反应的离子方程式:Cu2++S2-═CuS↓ | |
| C. | 氯气溶于水:Cl2+H2═2H++Cl-+ClO- | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2═4Na++2Cu(OH)2↓+O2↑ |
9.无机化合物可根据其组成和性质进行分类,如图
(1)以Na、K、H、O、C、S、N中任意两种或三种元素组成合
适的物质(填化学式),分别填在下表②③的后面.
(2)写出⑦转化为⑤的化学方程式:2NaOH+CO2=Na2CO3+H2O
(3)⑧中氧元素的化合价是-1呼吸面具中用⑧作为O2来源的反应原理为(用化学方程式表示2Na2O2+2CO2=2Na2CO3+O2
(4)简述实验室检验⑦的方法是将气体通入澄清石灰水中,若变浑浊,即可说明是CO2
(5)若制取标准状况下的CO2气体11.2L需要4mol•L-1的盐酸250毫升.

(1)以Na、K、H、O、C、S、N中任意两种或三种元素组成合
适的物质(填化学式),分别填在下表②③的后面.
| 物质 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ②H2SO4(或HNO3、H2CO3) | ③NaOH(或KOH) ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO4 | ⑦CO2 ⑧Na2O2 |
(3)⑧中氧元素的化合价是-1呼吸面具中用⑧作为O2来源的反应原理为(用化学方程式表示2Na2O2+2CO2=2Na2CO3+O2
(4)简述实验室检验⑦的方法是将气体通入澄清石灰水中,若变浑浊,即可说明是CO2
(5)若制取标准状况下的CO2气体11.2L需要4mol•L-1的盐酸250毫升.

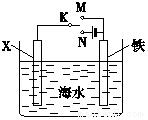 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护. 某化学课外小组使用铁丝做催化剂,用下图装置制取溴苯,先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组使用铁丝做催化剂,用下图装置制取溴苯,先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.