题目内容
18.在298K、1.01×10-3Pa下,将32gSO2通入750mL.1mol/LNaOH溶液中,充分反应,测得反应放出aKJ的热量.已知在该条件上,1molSO2通1L2mol/LNaOH溶液中,充分反应放出bKJ的热量.则SO2与NaOH溶液反应生成NaHSO3的热化学方程式是( )| A. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(2a-b)kJ/mol | |
| B. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(4b-a)kJ/mol | |
| C. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(a-4b)kJ/mol | |
| D. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(4a-b)kJ/mol |
分析 在298K、1.01×105Pa下,将32g SO2通入750mL 1mol/L NaOH溶液中充分反应,测得反应放出akJ的热量,则2molSO2与3molNaOH发生反应的热化学方程式为2SO2+3NaOH=NaHSO3+Na2SO3+H2O,△H=4akJ/mol,1mol SO2通入1L 2mol/L NaOH溶液中充分反应放出b kJ的热量,则1molSO2与2molNaOH发生反应的热化学方程式为SO2+2NaOH=Na2SO3+H2O,△H=bkJ/mol,根据盖斯定律答题.
解答 解:在298K、1.01×105Pa下,将32g SO2通入750mL 1mol/L NaOH溶液中充分反应,测得反应放出x kJ的热量,则2molSO2与3molNaOH发生反应的热化学方程式为①2SO2(g)+3NaOH(aq)=NaHSO3(aq)+Na2SO3(aq)+H2O(l),△H=-4akJ/mol,1mol SO2通入1L 2mol/L NaOH溶液中充分反应放出b kJ的热量,则1molSO2与2molNaOH发生反应的热化学方程式为②SO2(g)+2NaOH(aq)=Na2SO3(aq)+H2O(l),△H=-bkJ/mol,根据盖斯定律将①-②得SO2与NaOH溶液反应生成NaHSO3的热化学方程式为SO2(g)+NaOH(aq)=NaHSO3(aq),△H=-(4a-b)kJ/mol,即SO2(g)+NaOH(aq)=NaHSO3(aq),△H=-(4a-b)kJ/mol;
故选D.
点评 本题考查热化学方程式的书写和计算,是高考中常见题型,计算中涉及到化学方程式的有关计算问题和盖斯定律的有关应用,是一重点题型,学生还应注意在书写热化学方程式时标明各物质的状态.

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案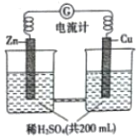 如图所示由锌片、铜片和稀H2SO4(密度为1.25g•cm-3)组成的原电池,一段时间后,若锌片只发生电化学反应,当在铜片上放出1.68L(标准状况下)气体时,H2SO4恰好梢耗一半,则原硫酸溶质的质量分数为( )
如图所示由锌片、铜片和稀H2SO4(密度为1.25g•cm-3)组成的原电池,一段时间后,若锌片只发生电化学反应,当在铜片上放出1.68L(标准状况下)气体时,H2SO4恰好梢耗一半,则原硫酸溶质的质量分数为( )| A. | 0.75% | B. | 2.94% | C. | 5.88% | D. | 11.76% |
| A. | 在熔融状态下不导电的化合物都是非电解质 | |
| B. | 液氯是纯净物,氯水是混合物,均不属于电解质 | |
| C. | SO2溶于水能导电,所以SO2是电解质 | |
| D. | 硫酸溶于水可以导电,所以浓硫酸是电解质 |
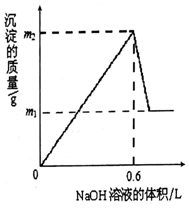 将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )| A. | m1-m2═10.2 | B. | 2c(H2SO4)+c(HNO3)═0.8 mol•L-1 | ||
| C. | 原合金中铝的质量分数为34.7% | D. | V=2.24 |
| A. | 2.3 gNa+中含有NA个电子 | |
| B. | 硫酸的摩尔质量与硫酸分子的质量相等 | |
| C. | NA个CC14分子在标准状况下的体积约为22.4 L | |
| D. | 18 g H2O中含有NA个H2、NA个O |
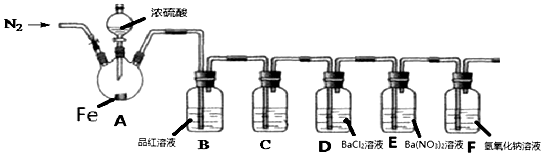
 “化学--人类进步的关键”.化学在生产生活中有着广泛的运用,尤其是化学反应原理.人们平时所用的铁及其化合物都跟化学有关.
“化学--人类进步的关键”.化学在生产生活中有着广泛的运用,尤其是化学反应原理.人们平时所用的铁及其化合物都跟化学有关.