题目内容
10.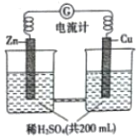 如图所示由锌片、铜片和稀H2SO4(密度为1.25g•cm-3)组成的原电池,一段时间后,若锌片只发生电化学反应,当在铜片上放出1.68L(标准状况下)气体时,H2SO4恰好梢耗一半,则原硫酸溶质的质量分数为( )
如图所示由锌片、铜片和稀H2SO4(密度为1.25g•cm-3)组成的原电池,一段时间后,若锌片只发生电化学反应,当在铜片上放出1.68L(标准状况下)气体时,H2SO4恰好梢耗一半,则原硫酸溶质的质量分数为( )| A. | 0.75% | B. | 2.94% | C. | 5.88% | D. | 11.76% |
分析 形成原电池时,锌为负极,发生氧化反应,电极方程式为Zn-2e-═Zn2+,铜为原电池正极,发生还原反应,电极方程式为2H++2e-═H2↑,电流由正极流向负极,结合电极方程式计算.
解答 解:铜电极方程式为2H++2e-═H2↑,n(H2)=$\frac{1.68L}{22.4L/mol}$=0.075mol,则参加反应的硫酸的物质的量为0.075mol,为0.075mol×98g/mol=7.35g,200mL硫酸正含有硫酸的质量为14.7g,其质量分数为$\frac{14.7g}{200mL×1.25g/mL}$×100%=2.94%,故选B.
点评 本题考查了原电池原理、物质的量的计算、溶液中溶质质量分数的计算等知识点,为高频考点,侧重于学生的分析能力和计算能力的考查,明确电极上电极反应、物质之间的关系即可解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列实验现象中,是由发生取代反应而造成的是 ( )
| A. | 乙烯通入溴的四氯化碳溶液中,溶液褪色 | |
| B. | 光照甲烷和氯气的混合气体后,瓶壁上有油状液滴附着 | |
| C. | 苯滴加到溴水中,震荡后水层接近无色 | |
| D. | 在葡萄糖溶液中加入新制的氢氧化铜,加热后产生砖红色沉淀 |
1.食盐在生活中应用广泛,下列不属于食盐用途的是( )
| A. | 着色 | B. | 防腐 | C. | 调味 | D. | 杀菌 |
18.己知:图1中a和b分别为常温下盐酸和NaOH溶液互滴的pH变化曲线;图2为常温下CaSO4在水中的沉淀溶解平衡曲线.下列相关叙述正确的是( )
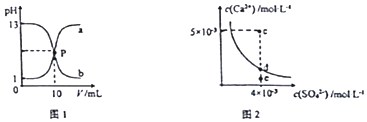

| A. | 图1中P点溶液:c(Na+ )=c(Cl-)>c(H+ )=c(OH- ) | |
| B. | 由图1可知盐酸和NaOH溶液的浓度均为1mol•L-1 | |
| C. | 图2中c点有沉淀生成,达平衡后溶液中c(SO42- )=3×10-3 mol•L-1 | |
| D. | 可通过蒸发将图 2中e点的溶液变到d点 |
15.W、X、Y、Z是短周期元素,在元素周期表中的相对位置如图所示,下列推断正确的是( )
| W | Y | |
| X | Z |
| A. | 若W的氧化物为WO2,则Z的最高价含氧酸一定为H2ZO4 | |
| B. | 若X的单质可作半导体材料,则Y的氢化物的水溶液一定显碱性 | |
| C. | 原子半径大小顺序一定为X>Z>Y>W | |
| D. | 最高正化合价大小顺序一定为Y=Z>X>W |
2. α-亚麻酸是人体必需的重要不饱和脂肪酸,具有增强智力、提高记忆力、保护视力、改善睡眠的作用.其结构简式如图所示,下列相关说法中不正确的是( )
α-亚麻酸是人体必需的重要不饱和脂肪酸,具有增强智力、提高记忆力、保护视力、改善睡眠的作用.其结构简式如图所示,下列相关说法中不正确的是( )
 α-亚麻酸是人体必需的重要不饱和脂肪酸,具有增强智力、提高记忆力、保护视力、改善睡眠的作用.其结构简式如图所示,下列相关说法中不正确的是( )
α-亚麻酸是人体必需的重要不饱和脂肪酸,具有增强智力、提高记忆力、保护视力、改善睡眠的作用.其结构简式如图所示,下列相关说法中不正确的是( )| A. | α-亚麻酸的分子式为C18H30O2 | |
| B. | α-亚麻酸能使酸性高锰酸钾溶液褪色 | |
| C. | α-亚麻酸在一定条件下能发生酯化反应与取代反应 | |
| D. | 1molα-亚麻酸最多能与4molBr2发生加成反应 |
18.在298K、1.01×10-3Pa下,将32gSO2通入750mL.1mol/LNaOH溶液中,充分反应,测得反应放出aKJ的热量.已知在该条件上,1molSO2通1L2mol/LNaOH溶液中,充分反应放出bKJ的热量.则SO2与NaOH溶液反应生成NaHSO3的热化学方程式是( )
| A. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(2a-b)kJ/mol | |
| B. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(4b-a)kJ/mol | |
| C. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(a-4b)kJ/mol | |
| D. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(4a-b)kJ/mol |