题目内容
17.下列晶体中由原子直接构成的单质有( )| A. | 硫 | B. | 氦气 | C. | 金刚石 | D. | 金属镁 |
分析 常见晶体有原子晶体、分子晶体、离子晶体以及金属晶体,其中原子晶体由原子构成,分子晶体由分子构成的,如水、氢气等分子晶体,离子晶体是由离子构成的,如氯化钠等离子晶体,金属晶体是由金属阳离子和自由电子构成,另外一些单原子分子由原子构成,以此解答该题.
解答 解:A.硫属于分子晶体,晶体直接由分子构成,故A错误;
B.氦气是单原子构成的分子,是由原子直接构成的,故B正确;
C.金刚石晶体属于原子晶体,是由原子直接构成的,故C正确;
D.金属镁是由镁离子和自由电子构成的,故D错误.
故选BC.
点评 本题考查晶体的类型以及组成的判断,为高频考点,侧重于学生的分析能力的考查,掌握常见物质的粒子构成是正确解答本题的关键,题目难度不大.

练习册系列答案
相关题目
7.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是Ar(填具体元素符号,下同),原子结构示意图为 ;元素⑩名称为Br.
;元素⑩名称为Br.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: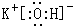 .
.
(3)元素⑤与⑦形成化合物的化学式为AlCl3;实验测得,当此化合物在液态或固态时不导电,溶解于水时能导电,由此判断该化合物属于共价化合物.
(4)元素③、⑥、⑦形成的气态氢化物中,沸点最高的物质的化学式是H2O,原因是H2O分子间含有氢键.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为Br.
;元素⑩名称为Br.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
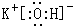 .
.(3)元素⑤与⑦形成化合物的化学式为AlCl3;实验测得,当此化合物在液态或固态时不导电,溶解于水时能导电,由此判断该化合物属于共价化合物.
(4)元素③、⑥、⑦形成的气态氢化物中,沸点最高的物质的化学式是H2O,原因是H2O分子间含有氢键.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
8.已知还原性I->Fe2+>Br-,下列离子方程式正确的是( )
| A. | 将少量Cl2通入FeBr2溶液中:Cl2+2Br-═Br2+2Cl- | |
| B. | 将足量Cl2通入FeBr2溶液中:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 将少量Cl2通入FeI2溶液中:2Fe2++2I-+3Cl2═2Fe3++2I2+6Cl- | |
| D. | 将672mLCl2(标况)通入250mL 0.1molL-1的FeI2溶液中:2Fe2++10I-+6Cl2═12Cl-+5I2+2Fe3+ |
5.对于反应N2+3H2?2NH3△H<0,下列肯定不是该反应达到平衡状态的标志是( )
| A. | 断开一个N≡N,同时有六个N-H键生成 | |
| B. | 生成氨的速率与分解氨的速率相等 | |
| C. | N2、H2,、NH3的质量分数不再变化 | |
| D. | 混合气体总压不再改变 |
12.下列液体均处于25℃,有关叙述正确的是( )
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 将1L0.1mol•L-1的Ba(OH)2溶液稀释为2L,pH=12 | |
| D. | pH=8的NaOH溶液稀释100倍,其pH=6 |
2.镁燃料电池具有比能量高,使用安全方便,原材料来源丰富、成本低,燃料易于贮运等特点.如图为镁一次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )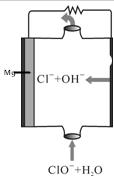

| A. | 电子由负极经电解质溶液移向正极 | |
| B. | ClO-参与的一极为正极 | |
| C. | 电池中镁为负极,发生氧化反应 | |
| D. | 放电过程中,溶液中Cl-的物质的量不变 |
10.某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)①,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)偏大.
(2)判断滴定终点的现象是:无色变为粉红色,半分钟内不变色.
(3)根据下列数据:请计算待测盐酸溶液的浓度:0.20mol/L.
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)①,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)偏大.
(2)判断滴定终点的现象是:无色变为粉红色,半分钟内不变色.
(3)根据下列数据:请计算待测盐酸溶液的浓度:0.20mol/L.
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00- | 24.00 |
11.碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如图所示,下列有关说法正确的是( )

| A. | 分子式为C3H2O3 | B. | 分子中只含有极性键 | ||
| C. | 分子中含6个σ键 | D. | 各碳原子杂化的方式不同 |

 +
+ →
→
 ,C:CH2=CHCOOCH3,D:
,C:CH2=CHCOOCH3,D: ,E:C18H37OH.
,E:C18H37OH.