题目内容
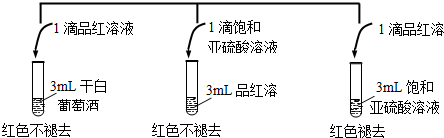
1.下列装置所示的分离提纯方法和物质的溶解性无关的是( )| A. |  | B. |  | ||
| C. |  | D. | 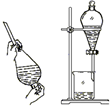 |
分析 利用溶解性差异进行分离的物质,对于气体,可用洗气的方法分离,对应可溶性物质,可用结晶的方法分离,对于液体,可用分液的方法分离,以此解答该题.
解答 解:A.蒸馏与沸点有关,故A选;
B.洗气可除去易溶性气体,与溶解性有关,故B不选;
C.溶解度随温度变化较大的物质,可用结晶的方法分离,故C不选;
D.互不相溶的液体,可用分液的方法分离,故D不选.
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握混合物分离方法及原理为解答的关键,侧重分析与应用能力的考查,注意混合物中物质的性质,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
12.下列化学用语正确的是( )
| A. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- | |
| B. | 醋酸铵的电离:CH3COONH4?CH3COO-+NH4+ | |
| C. | H2的燃烧热为285.8kJ/mol:H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-285.8kJ/mol | |
| D. | 碳在高温下还原二氧化硅 SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
9.周期表第二行中原子序数相连的X、Y、Z三种元素的连续电离能如下表,下列叙述正确的是( )
| 元素 | E1 | E2 | E3 | E4 |
| X | 522.05 | 7324.8 | 11856.6 | … |
| Y | 898.8 | 1763.58 | 14901.6 | 21084 |
| Z | 803.46 | 2436 | 3672.9 | 25116 |
| A. | X的原子电子层结构为1s22s1 | B. | Y为ⅡA族元素,其元素符号为Mg | ||
| C. | Z的价电子数为1 | D. | X的原子半径小于Y的原子半径 |
16.2015年氰化物成为热议话题.氢氰酸的结构式为H─C≡N,则N元素的化合价为( )
| A. | -3 | B. | +1 | C. | +3 | D. | +5 |
6.常温下,两种酸的电离平衡常数如下表:
常温下,浓度均为0.1mol/L的下列溶液:①Na2SO3;②Na2CO3;③NaHSO3,下列有关说法正确的是( )
| 酸 | 电离常数K1 | 电离常数K2 |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
| A. | pH:Na2CO3溶液小于Na2SO3溶液 | |
| B. | 结合H+能力:CO32-弱于SO32- | |
| C. | NaHSO3溶液显酸性的原因是:NaHSO3═Na++H++SO32- | |
| D. | ①与②溶液等体积混合后的溶液中:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-) |
10. 某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )
某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )
 某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )
某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )| A. | H2SO4浓度为4mol/L | B. | 溶液中最终溶质为FeSO4 | ||
| C. | 原混合酸中NO3-浓度为0.2mol/L | D. | AB段反应为:Fe+2Fe3+→3Fe2+ |
3.某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成.将该粉末与足量的盐酸反应有气体X逸出,X气体能被氢氧化钠溶液完全吸收.若将该粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原粉末的质量.下列判断正确的是( )
| A. | 粉末中一定有Na2O、Na2O2、NaHCO3 | |
| B. | 粉末中一定不含有Na2CO3和NaCl | |
| C. | 粉末中一定含有Na2O和NaHCO3 | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaCl |