题目内容
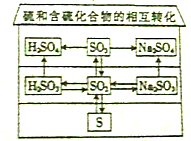
16.2015年氰化物成为热议话题.氢氰酸的结构式为H─C≡N,则N元素的化合价为( )| A. | -3 | B. | +1 | C. | +3 | D. | +5 |
分析 根据共用电子对偏移计算HCN中C元素的化合价.
解答 解:HCN的结构式为H-C≡N,将短线转化为共用电子对,且N原子含有1对孤电子对,分子中C、H之间共用电子对偏向C,使碳显-1价,而C、N之间三对共用电子对偏向N,使氮显-3,
故选A.
点评 本题考查微粒数目计算、电子式、化合价等,比较基础,注意共价化合物中共用电子对偏移与化合价关系.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
6.下列离子方程式正确的是( )
| A. | 苯酚与碳酸氢钠溶液混合:C6H5OH+HCO3-→C6H5O-+CO2↑+H2O | |
| B. | 向FeBr2溶液中通入等量Cl2:2Fe2++2Br-+2Cl2→2Fe3++Br2+4Cl- | |
| C. | 将Al投入NaOH的重水溶液:2Al+2OH-+2D2O→2AlO2-+3D2↑ | |
| D. | Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液:Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H2O |
1.下列装置所示的分离提纯方法和物质的溶解性无关的是( )
| A. |  | B. | 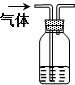 | ||
| C. | 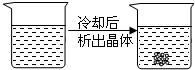 | D. | 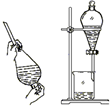 |
8.Na2FeO4是一种高效的水处理剂,下列用于解释事实的方程式中,不正确的是( )
| A. | Na2FeO4消毒、杀菌时得到的Fe3+可以净水,Fe3+能产生净水物质的原因是:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| B. | 工业上可用FeCl3、NaOH、NaClO三种物质反应制得Na2FeO4,化学方程式为:2FeCl3+10NaOH+3NaClO═2 Na2FeO4+9NaCl+5H2O | |
| C. | Na2FeO4在酸性溶液中不稳定,与水反应生成Fe3+和O2,离子方程式为:4FeO42-+10H2O═4Fe3++20OH-+3O2↑ | |
| D. | 工业上可用铁做阳极,电解浓NaOH溶液的方法制Na2FeO4,阳极的电极反应为:Fe-6e-+8OH-═FeO42-+4H2O |
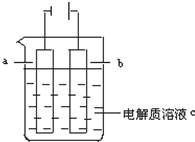 如图所示:
如图所示: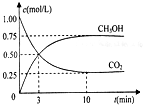 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.