题目内容
13.葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L.某兴趣小组设计实验方案对葡萄酒中SO2进行测定.Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为SO2(g)?SO2(aq)、SO2+H2O?H2SO3、H2SO3?H++HSO3-、HSO3-?H++SO32-.
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3.设计如下实验:
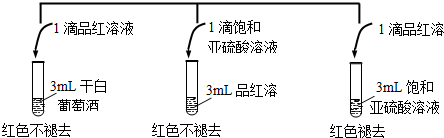
实验结论:干白葡萄酒不能使品红溶液褪色,原因为:干白中二氧化硫或亚硫酸含量太少.
Ⅱ.定量实验方案如下(部分装置和操作略):
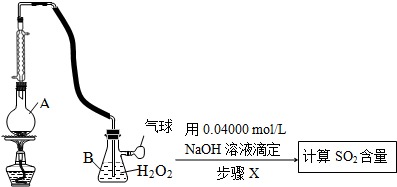
(3)仪器A的名称是圆底烧瓶.
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为SO2+H2O2═H2SO4.
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定,除去H2O2的方法是加入二氧化锰并振荡.
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为0.32 g/L.该测定结果比实际值偏高,分析原因盐酸的挥发造成的干扰.
分析 (1)二氧化硫与水反应生成亚硫酸,亚硫是二元弱酸,能分步电离;
(2)干白葡萄酒不能使品红溶液褪色的可能原因是干白葡萄酒中二氧化硫或亚硫酸含量太少;
(3)根据装置图可知仪器名称;
(4)二氧化硫与双氧水发生氧化还原反应生成硫酸;
(5)双氧水在二氧化锰作催化剂的条件下发生分解反应生成水和氧气;
(6)二氧化硫被氧化成硫酸,用过量的氢氧化钠中和,剩余的氢氧化钠用盐酸滴定,根据盐酸的物质的量及氢氧化钠的总物质的量可计算出与硫酸反应的氢氧化钠的物质的量,进而得出硫酸的物质的量,根据硫元素守恒计算二氧化硫及酒中的二氧化硫的含量;由于盐酸易挥发,有部分氯化氯会挥发到B装置中,所以会使氢氧化钠的用量偏多,据此分析;
解答 解:(1)二氧化硫与水反应生成亚硫酸,亚硫是二元弱酸,能分步电离,涉及的平衡方程式为SO2(g)?SO2(aq)、SO2+H2O?H2SO3、H2SO3?H++HSO3-、HSO3-?H++SO32-,
故答案为:SO2(g)?SO2(aq)、SO2+H2O?H2SO3、H2SO3?H++HSO3-、HSO3-?H++SO32-;
(2)干白葡萄酒不能使品红溶液褪色的可能原因是干白葡萄酒中二氧化硫或亚硫酸含量太少,
故答案为:干白中二氧化硫或亚硫酸含量太少;
(3)根据装置图可知仪器A名称为圆底烧瓶,
故答案为:圆底烧瓶;
(4)二氧化硫与双氧水发生氧化还原反应生成硫酸,反应的方程式为SO2+H2O2═H2SO4,
故答案为:SO2+H2O2═H2SO4;
(5)双氧水在二氧化锰作催化剂的条件下发生分解反应生成水和氧气,所以除去H2O2的方法是加入二氧化锰并振荡,
故答案为:加入二氧化锰并振荡;
(6)根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×(0.0400mol/L×0.025L)×64g/mol=0.032g,该葡萄酒中的二氧化硫含量为:$\frac{0.032g}{0.1L}$=0.32g/L,
由于盐酸易挥发,有部分氯化氯会挥发到B装置中,所以会使氢氧化钠的用量偏多,所以会导致测定结果比实际值偏高,
故答案为:0.32;盐酸的挥发造成的干扰.
点评 本题考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力.

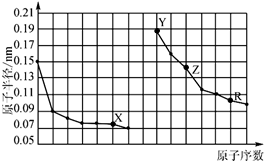
| A. | X、R的最高化合价相同 | |
| B. | 电解熔融的X与Z构成的化合物可以得到单质Z | |
| C. | X、Y形成的化合物中阳离子与阴离子的个数比一定是2:1 | |
| D. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 |
| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | Na2FeO4消毒、杀菌时得到的Fe3+可以净水,Fe3+能产生净水物质的原因是:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| B. | 工业上可用FeCl3、NaOH、NaClO三种物质反应制得Na2FeO4,化学方程式为:2FeCl3+10NaOH+3NaClO═2 Na2FeO4+9NaCl+5H2O | |
| C. | Na2FeO4在酸性溶液中不稳定,与水反应生成Fe3+和O2,离子方程式为:4FeO42-+10H2O═4Fe3++20OH-+3O2↑ | |
| D. | 工业上可用铁做阳极,电解浓NaOH溶液的方法制Na2FeO4,阳极的电极反应为:Fe-6e-+8OH-═FeO42-+4H2O |
| A. | 常温常压下,2.24L H2O中含有极性共价键的数目为0.2NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |
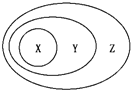
| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 溶液 | 分散系 | 混合物 |
| B | 铜 | 金属元素 | 元素 |
| C | 强电解质 | 电解质 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A. | A | B. | B | C. | C | D. | D |
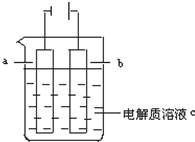 如图所示:
如图所示: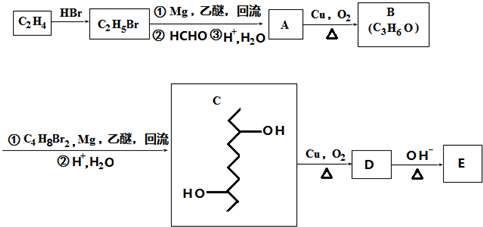
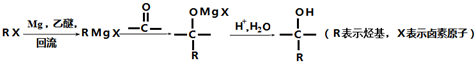

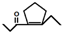 ,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式
,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式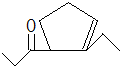 、
、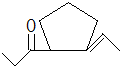 .
. 或
或