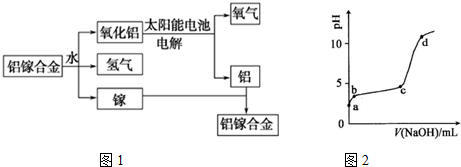
题目内容
6.常温下,两种酸的电离平衡常数如下表:| 酸 | 电离常数K1 | 电离常数K2 |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
| A. | pH:Na2CO3溶液小于Na2SO3溶液 | |
| B. | 结合H+能力:CO32-弱于SO32- | |
| C. | NaHSO3溶液显酸性的原因是:NaHSO3═Na++H++SO32- | |
| D. | ①与②溶液等体积混合后的溶液中:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-) |
分析 A.酸性越强,对应盐的水解程度越小;
B.酸性越强,对应酸根离子结合氢离子的能力越小;
C.HSO3-在溶液中部分电离;
D.Na2SO3与Na2CO3等物质的量混合,碳酸根离子的水解程度大于亚硫酸根离子.
解答 解:由电离常数可知,酸性:H2SO3>H2CO3>HSO3->HCO3-;
A.酸性越强,对应盐的水解程度越小,其pH越小,则pH:Na2CO3溶液大于Na2SO3溶液,故A错误;
B.酸性越强,对应酸根离子结合氢离子的能力越小,则结合H+能力:CO32-强于SO32-,故B错误;
C.HSO3-在溶液中部分电离,其电离方程式为:NaHSO3═Na++HSO3-,HSO3-?H++SO32-,故C错误;
D.Na2SO3与Na2CO3等物质的量混合,碳酸根离子的水解程度大于亚硫酸根离子,则离子浓度c(SO32-)>c(CO32-),水解生成的碳酸氢根离子浓度大于亚硫酸氢根离子浓度,所以溶液中:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-),故D正确.
故选D.
点评 本题考查了电离常数的应用、盐的水解、弱电解质的电离、离子浓度大小比较等,题目难度不大,注意根据酸的电离常数判断酸的酸性强弱.

练习册系列答案
相关题目
1.下列装置所示的分离提纯方法和物质的溶解性无关的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
18.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,2.24L H2O中含有极性共价键的数目为0.2NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |
15.如图是CO2生产甲醇的能量变化示意图.下列说法正确的是( )
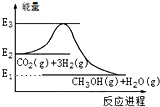

| A. | E2_E1是该反应的热效应 | |
| B. | E3_E1是该反应的热效应 | |
| C. | 该反应放热,在常温常压下就能进行 | |
| D. | 实现变废为宝,且有效控制温室效应 |
8.如图所示为硝酸铜晶体[Cu(NO3)2•nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),从图中获取如下信息,不正确的有 ( )
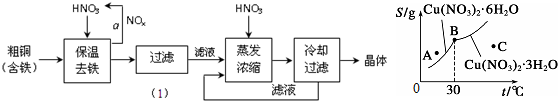

| A. | C点溶液为Cu(NO3)2的不饱和溶液 | |
| B. | 30℃时结晶可析出两种晶体 | |
| C. | 按上述流程最终得到的晶体是Cu(NO3)2•3H2O | |
| D. | 将A点溶液升温至30℃时,可以析出Cu(NO3)2•3H2O晶体. |
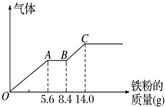 硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.
硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.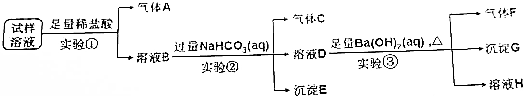
 .
.