题目内容
4.某化学小组研究盐酸被氧化的条件,进行如下实验.(1)研究盐酸被MnO2氧化.
| 实验 | 操作 | 现象 |
| I | 常温下将MnO2和12mol•L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| III | 加热MnO2和4mol•L-1稀盐酸混合物 | 无明显现象 |
②II中发生了分解反应,反应的化学方程式是MnCl4═Cl2↑+MnCl2.
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验(图1)IV进行探究:
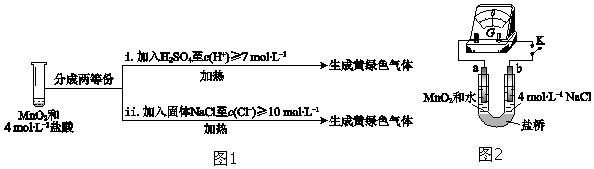
将实验 III、IV作对比,得出的结论是III中没有明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度才能被MnO2氧化;将 i、ii作对比,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-).
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强.
(2)研究盐酸能否被氧化性酸氧化.
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸不能(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2.
| 实验 | 操作 | 现象 |
| I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
| II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
| III | … | … |
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、c(Cl-)、c(H+)有关.
分析 (1)①已知MnO2呈弱碱性. I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化合物相互交换成分生成另外两种化合物的反应为复分解反应;
②将 I中混合物过滤,加热滤液生成大量黄绿色气体为氯气,说明分解产物有氯气,结合氧化还原反应单质守恒分析锰元素被还原的价态和物质;
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,将 i、ii作对比加热MnO2和4mol•L-1稀盐酸混合物,加入硫酸和加入氯化钠都生成黄绿色气体,其中氢离子浓度小于氯离子;
④向右管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针偏转幅度变化不大说明氢离子浓度影响不大;再向左管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针向左偏转幅度增大
,说明氢离子浓度对二氧化锰影响大;
(2)①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象,无氯气生成,为盐酸小液滴;
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2.说明硝酸钡还以为二氧化氮;操作Ⅲ对比验证二氧化氮是否能使湿润的淀粉碘化钾变蓝判断气体成分;
(3)上述分析可知,盐酸被氧化和氯离子浓度、氢离子浓度有关;
解答 解:(1)①常温下将MnO2和12mol•L-1浓盐酸混合,溶液呈浅棕色,略有刺激性气味,已知MnO2呈弱碱性. I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,结合元素化合价不变书写化学方程式MnO2+4HCl═MnCl4+2H2O,
故答案为:MnO2+4HCl═MnCl4+2H2O;
②将 I中混合物过滤,加热滤液生成大量黄绿色气体为氯气,说明分解产物有氯气,锰元素化合价降低是氯化锰,反应的化学方程式为:MnCl4═Cl2↑+MnCl2 ,
故答案为:MnCl4═Cl2↑+MnCl2 ;
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,将实验 III、IV作对比,得出的结论是III中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化,将 i、ii作对比,加热MnO2和4mol•L-1稀盐酸混合物,加入硫酸和加入氯化钠都生成黄绿色气体,其中氢离子浓度小于氯离子,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-),
故答案为:III中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化;MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-);
④向右管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针偏转幅度变化不大说明氢离子浓度影响不大;再向左管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针向左偏转幅度增大
,说明氢离子浓度对二氧化锰影响大,将ⅰ和ⅱ、ⅲ作对比,得出的结论是HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强,
故答案为:HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强;
(2)①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象,无氯气生成,说明盐酸未被浓硫酸氧化,白雾为盐酸小液滴,
故答案为:不能;
②将湿润的淀粉KI试纸伸入棕黄色气体中试纸先变蓝,后褪色,将湿润的淀粉KI试纸伸入纯净Cl2中试纸先变蓝,后褪色,气体中含氯气、二氧化氮,通过实验 I、II、III证明混合气体中含有Cl2,操作Ⅲ是验证纯净二氧化氮遇到湿润的淀粉KI试纸变化,操作是将湿润的淀粉KI试纸伸入纯净的NO2中,
故答案为:将湿润的淀粉KI试纸伸入纯净的NO2中;
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、c(Cl-)、c(H+)浓度有关,
故答案为:c(Cl-)、c(H+);
点评 本题考查了物质性质、操作的实验分析判断、对比试验推断结论、氧化还原反应影响因素的判断等,掌握基础是解题关键,题目难度中等.

| A. | 12g石墨烯( 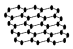 )中含有C-C键的数目为1.5NA )中含有C-C键的数目为1.5NA | |
| B. | 100g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA | |
| C. | 常温下,1 L0.5 mol/L NH4Cl溶液与2 L0.25 mol/L NH4Cl溶液所含NH4+的数目均为0.5 NA | |
| D. | 在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O反应中,每生成1 mol Cl2转移的电子数为2NA |
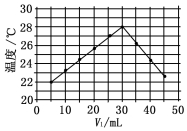 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A. | 做该实验时环境温度为22℃ | |
| B. | 该实验表明可将热能转化为化学能 | |
| C. | NaOH溶液的浓度约为1.5 mol•L-1 | |
| D. | 该实验表明有水生成的反应都是放热反应 |
| A. | 根据对角线规则,铍和铝的性质具有相似性 | |
| B. | 在H3O+、NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | O3与SO2的结构相似 | |
| D. | P4和CH4都是正四面体分子且键角都为109°28ˊ |
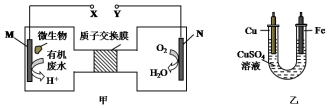
| A. | N为正极,铁电极应与Y相连接 | |
| B. | M电极反应式:CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ | |
| C. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g | |
| D. | H十透过质子交换膜由右向左移动 |
| 选项 | 实验内容 | 实验目的 |
| A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
| B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
| C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe (OH)3胶体 |
| D | 往混有FeCl2的CuCl2溶液中加人H2O2后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
| A. | A | B. | B | C. | C | D. | D |
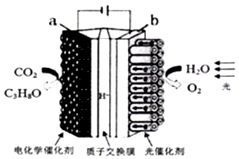 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | a电极的反应为:3CO2+16H+-18e-═C3H8O+4H2O | |
| C. | 该装置工作时,H+从b极区向a极区迁移 | |
| D. | 每生成1molO2有44gCO2被还原 |
| A. | 硅太阳能电池利用的是原电池原理 | |
| B. | 用干燥的钢瓶盛装液氯和用铁制容器盛装容器盛装浓硝酸的原理相同 | |
| C. | 含有活性炭的口罩可阻挡雾霾,其原理是利用活性炭的吸附作用 | |
| D. | 用菜籽油浸泡花椒制得花椒油后,用分液的方法将花椒油分离出来 |