题目内容
13.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)a微粒的结构示意图是
 .
.(2)b与e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
(4)c微粒的电子式
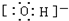 .
.(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
分析 a是单核且含有10电子的微粒,则a是Ne;
b是单核且带1个单位正电荷的离子,电子数为10,则b是Na+;
c是双核10电子微粒,且带一个单位负电荷,则c是OH-;
d是多核10电子分子,d是由共价键构成的四原子分子,则d是NH3;
e是单核带2个单位正电荷的10电子阳离子,则e是Mg2+;
f是多核带1个单位正电荷的10电子阳离子,g是多核分子且电子数为10的分子,c与f可形成两个共价型的g分子,则f是H3O+、g是H2O;
根据以上分析结合元素周期律知识进行解答.
解答 解:a是单核且含有10电子的微粒,则a是Ne;b是单核且带1个单位正电荷的离子,电子数为10,则b是Na+;c是双核10电子微粒,且带一个单位负电荷,则c是OH-;d是多核10电子分子,d是由共价键构成的四原子分子,则d是NH3;e是单核带2个单位正电荷的10电子阳离子,则e是Mg2+;f是多核带1个单位正电荷的10电子阳离子,g是多核分子且电子数为10的分子,c与f可形成两个共价型的g分子,则f是H3O+、g是H2O,
(1)a是Ne,Ne原子核外有2个电子层、最外层电子数是8,则Ne原子结构示意图为: ,
,
故答案为: ;
;
(2)金属性:Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性强弱为:NaOH>Mg(OH)2,
故答案为:NaOH;Mg(OH)2;
(3)D为氨气,氨水是若电解质存在电离平衡,电离生成铵根离子和氢氧根离子,电离方程式为:NH3•H2O?NH4++OH-;
故答案为:NH3•H2O?NH4++OH-;
(4)c为OH-,为带有1个单位负电荷的阴离子,其电子式为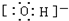 ,
,
故答案为: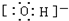 ;
;
(5)b为钠离子,其对应单质为钠,g为水,钠与水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,注意掌握原子结构与元素周期律、元素周期表的关系明确常见化学用语的概念及表示方法,试题培养了学生的分析能力及灵活应用能力.

 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案| A. |  除杂 | B. |  稀释 | ||
| C. |  制气 | D. |  称量 |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)碳酸氢钠是一种强(填“强”或“弱”)电解质,写出HCO3-水解的离子方程式:HCO3-+H2O?H2CO3+OH-,常温下,0.1mol•L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH- 五种微粒的浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
(3)实验室中常用NaOH来进行洗气和提纯.
几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
(4)难溶电解质FeS在水溶液中存在着溶解平衡:FeS(s)?Fe2+(aq)+S2-(aq),在一定温度Ksp=c(Fe2+)c(S2-)=6.25×10-18,在该温度下,氢硫酸饱和溶液中存在c2(H+)c(S2-)=1.0×10-22.将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0mol/L,应调节溶液的pH=2.4(已知lg2=0.3)
| A. | 元素的种类由原子的质量数决定 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次减弱 | |
| C. | 第三周期非金属元素所形成的所有含氧酸的酸性从左到右一定依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
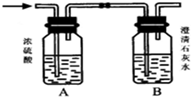 如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:
如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题: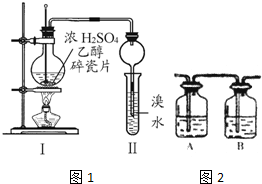 某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色)
某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色) .
.


