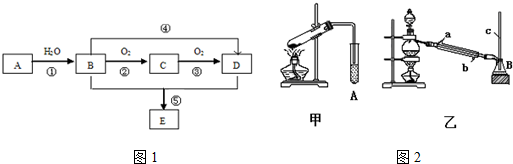
题目内容
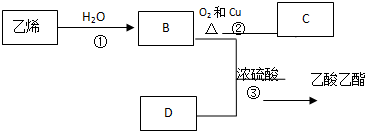
2.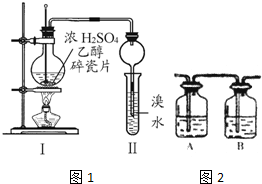 某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色)
某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色)已知:装置Ⅰ中生成乙烯的化学方程式 为C2H5OH→CH2═CH2↑+H2O
(1)写出乙烯的电子式
 .
.(2)溶液“变棕黑”,说明浓硫酸具有脱水性.
(3)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是BC.
A.乙烯与溴水易发生取代反应
B.使溴水褪色的反应,不一定是加成反应
C.使溴水褪色的物质,不一定是乙烯
(4)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是液体分两层,下层有油状液体,发生的反应方程式为CH2=CH2+Br2→CH2BrCH2B.
(5)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如图装置,则A中的试剂应为NaOH溶液,B中的试剂为品红溶液.
(6)写出乙醇在铜催化下氧化的方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
分析 乙醇在浓硫酸作用下加热到170℃可生成乙烯,反应中浓硫酸起到催化剂和脱水剂的作用,由于反应中浓硫酸与碳发生氧化还原反应,可生成具有二氧化硫,二氧化硫可使溴水褪色,应排除二氧化硫的影响,可用品红检验二氧化硫,用氢氧化钠溶液除去二氧化硫,以此解答该题.
解答 解:乙醇在浓硫酸作用下加热到170℃可生成乙烯,反应中浓硫酸起到催化剂和脱水剂的作用,由于反应中浓硫酸与碳发生氧化还原反应,可生成具有二氧化硫,二氧化硫可使溴水褪色,应排除二氧化硫的影响,可用品红检验二氧化硫,用氢氧化钠溶液除去二氧化硫,
(1)乙烯分子中碳碳以双键相连,碳剩余价键被H饱和,由此写出电子式为 ,故答案为:
,故答案为: ;
;
(2)溶液“变棕黑”,则生成碳,说明浓硫酸具有脱水性,故答案为:脱水;
(3)浓H2SO4具有强氧化性,将乙醇氧化成碳,并且可以进一步反应,C+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,SO2具有还原性,可以与Br2反应,SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,
故答案为:BC;
(4)溴水中的溴与反应生成的乙烯发生加成反应,方程式为:CH2=CH2+Br2→CH2BrCH2Br,1,2-二溴乙烷密度大于水在试管底层为油状物质,
故答案为:液体分两层,下层有油状液体;CH2=CH2+Br2→CH2BrCH2B;
(5)在Ⅰ和Ⅱ之间增加图2装置,A装置是为了除去SO2和CO2,可用NaOH溶液吸收;B装置是为了检验SO2是否除尽,可用品红溶液,
故答案为:NaOH溶液;品红溶液;
(6)乙醇催化氧化生成乙醛和水,其反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查物质的性质实验,为高频考点,侧重于学生的分析、实验能力的考查,明确实验原理是解本题关键,根据浓硫酸、乙烯的性质来分析解答,注意二氧化硫、乙烯都能使溴水褪色,但褪色原理不同,乙烯使溴水褪色是发生了加成反应,二氧化硫使溴水褪色是发生了氧化还原反应,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)a微粒的结构示意图是
 .
.(2)b与e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
(4)c微粒的电子式
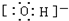 .
.(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| A. | 标准状况下,22.4 L苯中含有的分子数目为NA | |
| B. | 常温常压下,28g乙烯中含有碳碳双键数目为NA | |
| C. | 0.5mol•L-1K2SO4溶液中含有K+数目为NA | |
| D. | 28g铁与足量氯气反应失去的电子数目为NA |
| A. | CH4 | B. | C2H2 | C. | C2H4 | D. | C6H6 |
(1)它们的元素符号分别为:XH,YC,ZS.
(2)用价层电子对互斥理论判断:
| 物质 | 分子的价层电子对数 | 中心原子的杂化轨道类型 | 分子的立体构型名称 |
| X2Z | V形 | ||
| YZ2 |
| A. | ④②①③ | B. | ①③②④ | C. | ③②④① | D. | ③④①② |
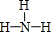 ;它的另一种氢化物R2H4是一种火箭燃料的成分,其电子式是
;它的另一种氢化物R2H4是一种火箭燃料的成分,其电子式是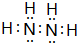 .
.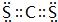 .
.
 .
.