题目内容
18.可用于分离或提纯物质的方法有:①过滤 ②结晶 ③升华④分液(填序号)a.除去石灰水中悬浮的碳酸钙颗粒①;
b.除去氯化钠中混有的碘单质(碘易由固态变为气态)③;
c.分离水与苯的混合物④;
d.分离氯化钠和硝酸钾的混合物②.
分析 a.碳酸钙不溶于水;
b.碘易升华,而NaCl加热不变化;
c.水和苯分层;
d.氯化钠和硝酸钾的溶解度受温度影响不同.
解答 解:a.碳酸钙不溶于水,可利用过滤法除去石灰水中悬浮的碳酸钙颗粒,故答案为:①;
b.碘易升华,而NaCl加热不变化,则利用升华法分离,故答案为:③;
c.水和苯分层,可选择分液法分离,故答案为:④;
d.氯化钠和硝酸钾的溶解度受温度影响不同,则选择结晶法分离,故答案为:②.
点评 本题考查混合物分离提纯,为高频考点,把握有机物的性质、性质差异、分离方法选择为解答的关键,侧重分析与应用能力的考查,注意混合物分离原理,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.某有机物在氧气里充分燃烧,生成的CO2和H2O的物质的量之比为1:1,由此可以得出该有机物( )
| A. | 分子中C、H、O的个数之比为1:2:3 | B. | 分子中肯定不含氧原子 | ||
| C. | 分子中C和H的个数之比为1:2 | D. | 分子中可能含有氧原子 |
6.有关下列化合物的说法正确的是( )
| A. | SO2可大量用于漂白食品 | B. | 干冰、AgI均可用于人工降雨 | ||
| C. | 四氧化三铁常用作红色油漆和涂料 | D. | 小苏打的主要成份是Na2CO3 |
13.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
其中:b的离子半径大于e的离子半径;d是溶于显碱性的四原子分子;g是常见的一种液体.试写出:
(1)a微粒的结构示意图是 .
.
(2)b与e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
(4)c微粒的电子式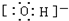 .
.
(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)a微粒的结构示意图是
 .
.(2)b与e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
(4)c微粒的电子式
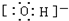 .
.(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
10.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 标准状况下,22.4 L苯中含有的分子数目为NA | |
| B. | 常温常压下,28g乙烯中含有碳碳双键数目为NA | |
| C. | 0.5mol•L-1K2SO4溶液中含有K+数目为NA | |
| D. | 28g铁与足量氯气反应失去的电子数目为NA |
8.下列有关实验现象或叙述中,不正确的是( )
| A. | 氢气在Cl2中燃烧,发出苍白色火焰 | |
| B. | 铵盐与碱共热产生气体能使干燥的红色石蕊试纸变蓝 | |
| C. | 实验室制氯气用饱和食盐水除去氯化氢 | |
| D. | 铜丝在Cl2中燃烧,生成棕黄色烟 |
 .
.
 的物质,该物质是一种香料.
的物质,该物质是一种香料. $→_{CH_{3}-CH=CH_{2}}^{①催化剂}$
$→_{CH_{3}-CH=CH_{2}}^{①催化剂}$ $→_{Br_{2}}^{②光照}$A(一溴代物)$\stackrel{③}{→}$B$→_{HBr}^{④加成反应}$C$\stackrel{⑤}{→}$ D$\stackrel{⑥氧化反应}{→}$
$→_{Br_{2}}^{②光照}$A(一溴代物)$\stackrel{③}{→}$B$→_{HBr}^{④加成反应}$C$\stackrel{⑤}{→}$ D$\stackrel{⑥氧化反应}{→}$
 含有的官能团的名称为醛基.
含有的官能团的名称为醛基. (有机物写结构简式,并注明反应条件,下同).
(有机物写结构简式,并注明反应条件,下同). +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$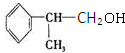 +NaBr.
+NaBr. 的水解产物
的水解产物 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低. 或
或 .
.
 .
.