题目内容
4.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )| A. |  除杂 | B. |  稀释 | ||
| C. |  制气 | D. |  称量 |
分析 A.HCl极易溶于水,食盐水抑制氯气的溶解,但导管应长进短出;
B.不能在量筒中稀释;
C.加热氯化铵与氢氧化钙生成氨气,氨气的密度比空气密度小;
D.NaOH易潮解,具有腐蚀性.
解答 解:A.HCl极易溶于水,食盐水抑制氯气的溶解,但导管应长进短出,图中气体的进入方向不合理,故A错误;
B.不能在量筒中稀释,应在烧杯中稀释、冷却,故B错误;
C.加热氯化铵与氢氧化钙生成氨气,氨气的密度比空气密度小,且防止氨气逸出,试管口塞一团棉花,图中装置可制备氨气,故C正确;
D.NaOH易潮解,具有腐蚀性,应在小烧杯中称量,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、实验操作及实验技能、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12. HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
(1)浓度不同HNO3氧化性不同,试举一例说明浓硝酸能与碳反应,而稀硝酸不能.
(2)HNO3能氧化多种金属.金属活动顺序中,Ag以前的金属都能与HNO3反应,但常温下Fe、Al(填元素符号)在浓HNO3中能钝化.
(3)盐酸对HNO3氧化性有影响.浓硝酸与浓盐酸按1:3体积比混合所得混合液称王水,具有强氧化性.金溶于王水产生遇空气变色的气体,金转化为易溶性强酸H[AuCl4].请写出其离子方程式:Au+4H++NO3-+4Cl-=NO↑+AuCl4-+2H2O.
(4)与金属反应的过程中,HNO3能被还原成多种含氮产物,如:NO2、HNO2、NO、N2O、N2、NH2OH、NH4+(或硝酸铵NH4NO3).
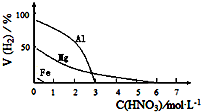
(5)HNO3是一种强酸,与活泼金属反应时,HNO3的还原产物中可能存在H2,某兴趣小组设计实验,探究金属与稀HNO3反应制取H2的影响因素,其结果如图所示.
该兴趣小组设计以下实验,探究金属与HNO3反应产生H2的影响因素可供选择的试剂:Fe粉、Mg粉,HNO3(0.1mol•L-1、2.0mol•L-1)
有同学认为,金属与HNO3反应是放热反应,温度也会影响金属与HNO3反应产生H2,反应器需要置于冷水浴中保持常温.
 HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:(1)浓度不同HNO3氧化性不同,试举一例说明浓硝酸能与碳反应,而稀硝酸不能.
(2)HNO3能氧化多种金属.金属活动顺序中,Ag以前的金属都能与HNO3反应,但常温下Fe、Al(填元素符号)在浓HNO3中能钝化.
(3)盐酸对HNO3氧化性有影响.浓硝酸与浓盐酸按1:3体积比混合所得混合液称王水,具有强氧化性.金溶于王水产生遇空气变色的气体,金转化为易溶性强酸H[AuCl4].请写出其离子方程式:Au+4H++NO3-+4Cl-=NO↑+AuCl4-+2H2O.
(4)与金属反应的过程中,HNO3能被还原成多种含氮产物,如:NO2、HNO2、NO、N2O、N2、NH2OH、NH4+(或硝酸铵NH4NO3).
(5)HNO3是一种强酸,与活泼金属反应时,HNO3的还原产物中可能存在H2,某兴趣小组设计实验,探究金属与稀HNO3反应制取H2的影响因素,其结果如图所示.
该兴趣小组设计以下实验,探究金属与HNO3反应产生H2的影响因素可供选择的试剂:Fe粉、Mg粉,HNO3(0.1mol•L-1、2.0mol•L-1)
| 影响因素 | 实验步骤 | 实验结论 |
| 金属的种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入2mol•L-1 HNO3溶液50mL,反应结束后,用气体分析仪测定气体中H2的体积分数 | 在该浓度的稀HNO3中,Mg能反应, Fe粉不反应, |
| 硝酸的浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入0.1mol•L-1HNO3、2.0mol•L-1HNO3,反应结束后,用气体分析仪测定气体中H2的体积分数 | 硝酸浓度越稀,产生氢气越多. |
13.说法正确的是( )
| A. | 所有过渡元素都是金属元素 | |
| B. | CaO2和CaCl2含有的化学键类型完全相同 | |
| C. | 非金属原子之间不可能形成离子键 | |
| D. | 有化学键断裂的过程一定属于化学变化 |
9.某有机物在氧气里充分燃烧,生成的CO2和H2O的物质的量之比为1:1,由此可以得出该有机物( )
| A. | 分子中C、H、O的个数之比为1:2:3 | B. | 分子中肯定不含氧原子 | ||
| C. | 分子中C和H的个数之比为1:2 | D. | 分子中可能含有氧原子 |
13.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
其中:b的离子半径大于e的离子半径;d是溶于显碱性的四原子分子;g是常见的一种液体.试写出:
(1)a微粒的结构示意图是 .
.
(2)b与e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
(4)c微粒的电子式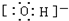 .
.
(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)a微粒的结构示意图是
 .
.(2)b与e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-.
(4)c微粒的电子式
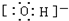 .
.(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
14.已知X、Y、Z均为短周期元素,它们之间可形成X2Z和YZ2两种化合物,X、Y、Z的原子序数依次增大,X原子K层的电子数只有一个,Y位于X的下一周期,它的最外层电子数比K层多2个,而Z原子核外的最外层电子数比次外层少2个,请回答下列问题;
(1)它们的元素符号分别为:XH,YC,ZS.
(2)用价层电子对互斥理论判断:
(3)N2O双称笑气,N2O与YZ2具有相似的分子结构,请分析原因:二者互为等电子体.
(1)它们的元素符号分别为:XH,YC,ZS.
(2)用价层电子对互斥理论判断:
| 物质 | 分子的价层电子对数 | 中心原子的杂化轨道类型 | 分子的立体构型名称 |
| X2Z | V形 | ||
| YZ2 |
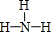 ;它的另一种氢化物R2H4是一种火箭燃料的成分,其电子式是
;它的另一种氢化物R2H4是一种火箭燃料的成分,其电子式是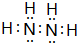 .
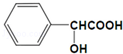
.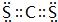 .
.
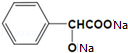 +H2↑.
+H2↑.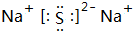 .
.