题目内容
9.某实验室用的蒸馏水,可以被某种酸严重污染,采用下列几种方法进行检验,其中不可行的是( )| A. | 取样品,向其中滴加石蕊试液 | B. | 取样品,向其中加入CaCO3粉末 | ||
| C. | 取样品,向其中滴加Ba(NO3)2溶液 | D. | 取样品,向其中滴加Na2CO3溶液 |
分析 被酸严重腐蚀,则溶液具有较强的酸性,可根据酸的通性鉴别,以此解答该题.
解答 解:A.向其中滴加石蕊试液,溶液呈酸性,则变为红色,可鉴别,故A不选;
B.溶液呈酸性,加入碳酸钙,固体溶解,生成气体,可鉴别,故B不选;
C.溶液呈酸性,加入硝酸钡溶液不一定生成沉淀,不能鉴别,故C选;
D.加碳酸钠,溶液呈酸性,可生成二氧化碳气体,可鉴别,故D不选.
故选C.
点评 本题考查物质的检验和鉴别,侧重于学生的分析、实验能力的考查,注意把握物质的性质,为解答该题的关键,难度不大.

练习册系列答案
相关题目
19.短周期主族元素W、X、Y、Z在周期表中的位置如下所示,Z是构成地壳的主要非金属元素之一.下列说法正确的是( )
| W | X | |
| Y | Z |
| A. | 最高正化合价:Y>W=Z>X | |
| B. | 原子半径:X>W>Z>Y | |
| C. | W、Y、Z的最高价含氧酸的钠盐溶液都能与CO2反应 | |
| D. | 最高价氧化物对应的水化物的酸性:Y<W<Z<X |
20.某反应在不同条件下的能量变化示意图如下,有关该图的说法正确的是( )


| A. | 该反应是吸热反应 | |
| B. | 虚线代表的是使用了催化剂的反应图象,且降低了反应的活化能 | |
| C. | 两种条件下反应的热效应相同,且实线代表的反应速率较快 | |
| D. | 该反应的△H=E5-E1=E4-E2=E3 |
17.甲乙两种非金属性质比较,有①甲比乙在相同条件下更容易与氢气化合;②甲单质能与乙的阴离子发生置换反应;③最高价氧化物对应的水化物酸性比较,甲比乙的强;④与一定量某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低.能够说明甲比乙的非金属性强的是( )
| A. | ①②③ | B. | ①③④ | C. | ①②⑤ | D. | ①②③④⑤ |
4.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1molMg变成Mg2+时失去的电子数为NA | |
| B. | 标准状况下,22.4L氮气含有的氮原子数为NA | |
| C. | 48gO3所含氧原子数为3NA | |
| D. | 18gH2O中所含的电子数我8NA |
9.表是元素周期表一部分,列出了十个元素在周期表中的位置:
请用化学用语回答下列问题
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程 .
.
(5)写出工业冶炼⑤的化学方程式:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(6)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-═2Cl-+Br2第二步:Br2+SO2+2H2O=4H++SO42-+2Br-;第三步Cl2+2Br-═2Cl-+Br2.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程
 .
.(5)写出工业冶炼⑤的化学方程式:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(6)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-═2Cl-+Br2第二步:Br2+SO2+2H2O=4H++SO42-+2Br-;第三步Cl2+2Br-═2Cl-+Br2.
6.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一.从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:①2Sb2S3+3O2+6Fe═Sb4O6+6FeS ②Sb4O6+6C═4Sb+6CO 关于反应①、②的说法正确的是( )
| A. | 反应①②中的氧化剂分别是Sb2S3、Sb4O6 | |
| B. | 反应①中每生成3molFeS时,共转移6mol电子 | |
| C. | 反应②说明高温下Sb的还原性比C强 | |
| D. | 每生成4molSb时,反应①与反应②中还原剂的物质的量之比为3:4 |
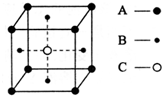 根据题意回答下列问题
根据题意回答下列问题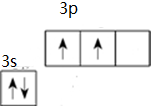 .
.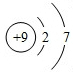 .
.