题目内容
2. 根据题意回答下列问题
根据题意回答下列问题①Fe2+的电子排布式为1s22s22p63s23p63d6.
②基态铜原子简化电子排布式为[Ar]3d104s1.
③Si原子价电子排布图为
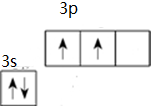 .
.④第二周期非金属元素第一电离能由小到大的次序为B、C、O、N、F.
⑤氟原子的原子结构示意图为
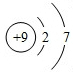 .
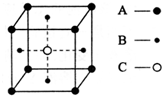
.⑥某物质的晶体中含有A、B、C三种元素,其排列方式如图所示(其中前后两面面心中的B元素的原子未能画出).
则晶体中A、B、C的原子个数比为1:3:1.
分析 ①铁原子失去最外层4s能级2个电子形成Fe2+,再根据核外电子排布规律进行书写;
②Cu原子核外有29个电子,其3d、4s电子为外围电子,其余电子与Ar的电子排布相同;
③Si属于14号元素,硅原子最外层含有4个电子,其价电子为2s22p2;
④同周期元素,从左到右第一电离能呈现增大的趋势,但N的最外层电子半满为稳定结构,则第一电离能N>O;
⑤氟原子序数为9,原子结构示意图为: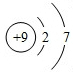 ;
;
⑥利用均摊法计算该小正方体中各种原子个数,顶点上的原子被8个小正方体共用,面心上的原子被2个小正方体共用,体心上的原子被1个小正方体占有.
解答 解:①铁原子失去最外层4s能级2个电子形成Fe2+,其核外电子排布式为1s22s22p63s23p63d6,
故答案为:1s22s22p63s23p63d6;
②Cu原子核外有29个电子,其3d、4s电子为外围电子,其余电子与Ar的电子排布相同,所以其简化电子排布式为:[Ar]3d104s1,
故答案为:[Ar]3d104s1;
③Si属于14号元素,硅原子最外层含有4个电子,Si原子核外有14个电子,3s、3p电子为其价电子,根据构造原理书写其价电子排布图 ,
,
故答案为: ;
;
④同周期元素,从左到右第一电离能呈现增大的趋势,但N的最外层电子半满为稳定结构,则第一电离能N>O,则第一电离能由小到大的次序是B、C、O、N、F,
故答案为:B、C、O、N、F;
⑤氟原子序数为9,原子结构示意图为: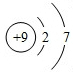 ,
,
故答案为: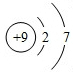 ;
;
⑥根据图片知,该小正方体中A原子个数=8×$\frac{1}{8}$=1,B原子个数=6×$\frac{1}{2}$=3,C原子个数=1,所以晶体中A、B、C的原子个数比为1:3:1,
故答案为:1:3:1.
点评 本题考查物质结构与性质,涉及核外电子排布、价电子排布图、第一电离能、晶胞计算,注重对物质结构中常考考点的考查,难度中等.

| A. | (CH3)2C═O+HCN→(CH3)2C(OH)CN 属于加成反应 | |
| B. | CH3OH、CH2OHCH2OH、CH2OHCHOHCH2OH是同系物 | |
| C. |  属于取代反应 属于取代反应 | |
| D. | 1molCH3CH3与Cl2完全反应生成六氯乙烷时,消耗Cl26mol |
| A. | 取样品,向其中滴加石蕊试液 | B. | 取样品,向其中加入CaCO3粉末 | ||
| C. | 取样品,向其中滴加Ba(NO3)2溶液 | D. | 取样品,向其中滴加Na2CO3溶液 |
| A. | 丙烷 | B. | 乙烷和丙烷 | C. | 乙烷和甲烷 | D. | 戊烷和己烷 |
 .
.
 .分别写出②和⑦、③和⑧化合产物的电子式
.分别写出②和⑦、③和⑧化合产物的电子式 、
、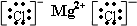 .⑤和⑥的气态氢化物的稳定性NH3>CH4(写化学式).⑦和⑧的最高价氧化物的水化物的酸性HClO4>H2SO4(写化学式).
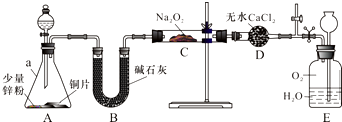
.⑤和⑥的气态氢化物的稳定性NH3>CH4(写化学式).⑦和⑧的最高价氧化物的水化物的酸性HClO4>H2SO4(写化学式).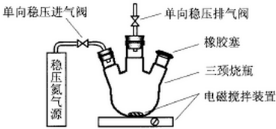 水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.
水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.