题目内容
9.表是元素周期表一部分,列出了十个元素在周期表中的位置:| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程
 .
.(5)写出工业冶炼⑤的化学方程式:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(6)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-═2Cl-+Br2第二步:Br2+SO2+2H2O=4H++SO42-+2Br-;第三步Cl2+2Br-═2Cl-+Br2.
分析 由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为N、⑧为Cl、⑨为Br、⑩为Ar,
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;氢氧化铝是两性氢氧化物;
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M为NH4NO3;
(4)③与⑧形成化合物为MgCl2,属于离子化合物;
(5)⑤为Al,工业上通过电解熔融氧化铝的方法获得金属铝;
(6)海水提溴原理:先将浓缩海水中的Br-用氯气氧化,再将溴吹入吸收塔,使溴蒸汽和二氧化硫吸收剂发生作用转变成氢溴酸得到富集溴,用氯气将富集的溴负离子氧化得到产品溴.
解答 解:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为N、⑧为Cl、⑨为Br、⑩为Ar,
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故③~⑦元素中,原子半径最大的是Ca,
故答案为:Ca;
(2)上述元素中Cl元素非金属性最强,故最高价含氧酸中HClO4的酸性最强;Al(OH)3是两性氢氧化物,
故答案为:HClO4;Al(OH)3;
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M为NH4NO3,含有离子键、共价键,
故答案为:离子键、共价键;
(4)③与⑧形成化合物为MgCl2,属于离子化合物,用电子式表示其形成过程为: ,
,
故答案为:: ;
;
(5)⑤为铝,工业上冶炼铝的方法是电解熔融氧化铝,反应的化学方程式为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
故答案为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
(6)将溴吹入吸收塔,使溴蒸汽和二氧化硫吸收剂发生作用转变成氢溴酸得到富集溴,反应的离子方程式为:Br2+SO2+2H2O=4H++SO42-+2Br-,
故答案为:Br2+SO2+2H2O=4H++SO42-+2Br-.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,明确元素周期表结构为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的分析能力及灵活应用能力.

| A. |  和CH2═CH-CH═CH2 和CH2═CH-CH═CH2 | |
| B. |  和 和 | |
| C. |  | |
| D. |  H2N(CH2)4NH2和OHC(CH2)4CHO H2N(CH2)4NH2和OHC(CH2)4CHO |
 .下列有关该有机物叙述正确的是( )
.下列有关该有机物叙述正确的是( )| A. | 分子式为C8H10NO2 | |
| B. | 其属于α-氨基酸的同分异构体有3种 | |
| C. | 该有机物属于α-氨基酸 | |
| D. | 该有机物可与FeCl3溶液发生显色反应 |
| A. | 取样品,向其中滴加石蕊试液 | B. | 取样品,向其中加入CaCO3粉末 | ||
| C. | 取样品,向其中滴加Ba(NO3)2溶液 | D. | 取样品,向其中滴加Na2CO3溶液 |
| A. | C:1s22s22p2 | B. | Na+:1s22s22p43s2 | ||
| C. | S2-:1s22s22p23s23p4 | D. | K:1s22s22p63s23p7 |
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0.
可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | 容器中CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1 | |
| B. | v正(CO2)=3v逆(H2) | |
| C. | 容器内混合气体平均相对分子质量保持不变 | |
| D. | 容器中CO2、H2、CH3OH、H2O的物质的量浓度都相等 |
| A. | 常温常压下,33.6 L氯气与27 g铝充分反应,转移电子数为3NA | |
| B. | 标准状况下,分子数为NA的CO、N2混合气体体积为22.4 L,其质量为28 g | |
| C. | 50 mL 8 mol•L-1的浓盐酸与足量的MnO2加热反应,生成Cl2的分子数为0.1NA | |
| D. | 标准状况下,80 g SO3中含3NA个氧原子,体积为22.4 L |
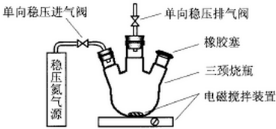 水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.
水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.
 .
.