题目内容
18.在日常生活中,为了达到更好的清洁效果,经常有人会将洁厕液(含有盐酸)与84消毒液混合使用,从而会发生引发中毒的事故.(1)两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是第三周期ⅦA族.
(2)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:
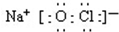 .
.(3)洁厕灵的主要成分是HCl.下列关于卤化氢的性质比较中错误的是
A.酸性:HF>HCl>HBr>HIB.键能:H-F>H-Cl>H-Br>H-I
C.熔点:HF<HCl<HBr<HID.还原性:HF<HCl<HBr<HI
(4)常温下,0.1mol/L的NaClO溶液的pH=9.7,原因次氯酸根离子水解溶液显碱性,ClO-+H2O?HClO+OH-.常温下HClO的电离平衡常数为10-6.4.洁厕液与84消毒液混合后会生成有毒的氯气.写出该反应的离子方程式ClO-+Cl-+2H+=Cl2↑+H2O.
(5)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-.
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH═K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用d溶液(填序号)
a.水b.NH4Cl、异丙醇c.Fe(NO3)3、异丙醇d.CH3COONa、异丙醇
(6)消毒效率是物质单位质量得到的电子数,则Cl2与NaClO两种消毒剂的消毒效率之比为149:142.
分析 (1)氯的原子序数为17,原子核外有3个电子层,最外层电子数为7,以此可确定在周期表中的位置;
(2)根据次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对;
(3)A、无氧酸的酸性,取决于非金属的电负性,电负性越大,酸性越弱;
B、原子半径越大,共价键键长越大,键能越小;
C、结构和组成相似的分子晶体,相对分子质量越大,分子间作用力越大,有氢键的熔点变大;
D、元素的非金属性越强,对应氢化物的还原性越弱;
(4)常温下,0.1mol/L的NaClO溶液的pH=9.7,溶液显碱性,次氯酸钠溶液中次氯酸根离子水解显碱性,电离平衡常数K=$\frac{[Cl{O}^{-}][{H}^{+}]}{[HClO]}$,依据水解平衡常数和溶液中离子积常数计算,洁厕液与84消毒液混合后会生成有毒的氯气,是洁厕净中盐酸和84消毒液中氯离子、次氯酸根离子发生氧化还原反应生成氯气;
(5)①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,结合电荷守恒和原子守恒配平书写离子方程式;
②选择的洗涤剂应能抑制K2FeO4的水解,并注意减少K2FeO4的溶解.
(6)设质量都是71g,利用单位质量得到的电子数来分析消毒效率.
解答 解:(1)氯的原子序数为17,原子核外有3个电子层,最外层电子数为7,则应位于周期表第三周期ⅦA族,
故答案为:第三周期ⅦA 族;
(2 )次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对,电子式为: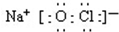 ,
,
故答案为: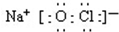 ;
;
(3)A、F、Cl、Br、I的电负性依次减弱,电负性越大,酸性越弱,故其氢化物的酸性依次增强,故A错误;
B、原子半径越大,共价键键长越大,键能越小,原子半径:F<Cl<Br<I,则共价键的键长:H-F<H-C1<H-Br<H-I,键能:H-F>H-Cl>H-Br>H-I,故B正确;
C、四种物质都是分子晶体,组成和结构相似,分子的相对分子质量越大,分子间作用力越大,则其熔沸点越高,但是HF中氢键熔点反常,比卤素的其他氢化物熔点高,所以熔点由低到高:HCl<HBr<HI<HF,故C错误;
D、元素的非金属性越强,对应氢化物的还原性越弱,因为非金属性:F>Cl>Br>I,故还原性:HF<HCl<HBr<HI,故D正确,
故选:AC;
(4)常温下,0.1mol/L的NaClO溶液的pH=9.7,溶液显碱性,次氯酸钠溶液中次氯酸根离子水解显碱性,反应的离子方程式为:ClO-+H2O?HClO+OH-,常温下,0.1mol/L的NaClO溶液的pH=9.7,ClO-+H2O?HClO+OH-,Kh=$\frac{[O{H}^{-}][HClO]}{[Cl{O}^{-}]}$=$\frac{[O{H}^{-}][HClO]}{[Cl{O}^{-}]}$×$\frac{[{H}^{+}]}{[{H}^{+}]}$=$\frac{Kw}{Ka}$,则Ka=$\frac{1{0}^{-14}}{\frac{[O{H}^{-}][HClO]}{[Cl{O}^{-}]}}$=$\frac{1{0}^{-14}×0.1mol/L}{1{0}^{-4.3}×1{0}^{-4.3}}$=10-6.4,
次氯酸钠有强氧化性,盐酸有强还原性,两者相遇发生氧化还原反应生成氯气,方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O,离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,
故答案为:次氯酸根离子水解溶液显碱性,ClO-+H2O?HClO+OH-,10-6.4,ClO-+Cl-+2H+=Cl2↑+H2O;
(5)①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-,
②为抑制K2FeO4的水解,应在碱性条件下洗涤,可用CH3COONa,为防止K2FeO4的溶解,可用异丙醇洗涤,
故答案为:d;
(6)设质量都是71g,氯气得到的电子数为 $\frac{71g}{71g/mol}$×2×1=2mol,
NaClO得到的电子数为 $\frac{71g}{74.5g/mol}$×1×2=$\frac{142}{74.5}$ mol,
则Cl2消毒的效率是NaClO的倍数为=$\frac{2}{\frac{142}{74.5}}$=$\frac{149}{142}$,
故答案为:149:142;
点评 本题综合考查氯的化合物的性质以及卤素的性质比较,题目较为综合,难度较大,注意把握题给信息,尤其是氧化还原反应知识的运用.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能自发进行 | |
| C. | 反应物和生成物所具有的总焓决定了反应是放热还是吸热 | |
| D. | 放热反应在任何条件下也能发生反应 |
| A. | 在常温常压下,11.2 L Cl2含有的分子数为0.5NA | |
| B. | 在常温常压下,17 g NH3所含的原子数为4NA | |
| C. | 标准状况下,11.2 L CCl4所含的分子数为0.5NA | |
| D. | 56g金属铁与足量的氯气反应时,失去的电子数为2NA |
| A. | 浓硝酸 | B. | 新制溴水 | C. | 浓盐酸 | D. | 硝酸银溶液 |
| A. | 二氧化硅和氯化镁熔化 | B. | 碘和氯化铵受热变成气体 | ||
| C. | 碘和干冰的升华 | D. | 氯化钠和氯化氢溶于水 | ||
| E. | 硅和蔗糖的熔化 | F. | 酒精和水的挥发 |
| A. | 150mL1mol•L-1NaCl溶液 | B. | 75mL2mol•L-1CaCl2溶液 | ||
| C. | 150mL3mol•L-1KCl溶液 | D. | 75mL3mol•L-1FeCl3溶液 |
 已知A、B、X、Y四种常见物质(其中A、B为单质,X、Y为化合物)有如图所示的转化关系(反应条件已略去);则X不可能为( )
已知A、B、X、Y四种常见物质(其中A、B为单质,X、Y为化合物)有如图所示的转化关系(反应条件已略去);则X不可能为( )| A. | CO2 | B. | H2O | C. | Fe3O4 | D. | SO3 |
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.4mol/L | D. | 0.8mol/L |