题目内容
9.用类推的方法可能会得出错误结论,因此推出的结论要经过实践的检验才能确定其正确与否.下列推论中正确的是( )①Na与氧气反应生成过氧化钠,锂与氧气反应生成过氧化锂
②Ca(HCO3)2的溶解度大于CaCO3,NaHCO3的溶解度大于Na2CO3
③Fe3O4可以写成FeO•Fe2O3的形式,Pb3O4也可写成PbO•Pb2O3的形式
④Al3+与S2-在溶液中可发生双水解反应生成沉淀和气体,Fe3+和S2-也如此
⑤可以用铝制或铁制容器常温下贮运浓硫酸,也可贮运浓硝酸
⑥电解CuCl2溶液阴极析出Cu,电解AlCl3溶液阴极上析出的是Al.
| A. | 1句 | B. | 2句 | C. | 3句 | D. | 4句 |
分析 ①锂与氧气反应只生成氧化锂;
②相同条件下,Na2CO3的溶解度大于NaHCO3;
③Pb在化合物里显+2价或+4价,根据化合价代数和为零的原则写出Pb的两种氧化物形式;
④三价铁离子具有强的氧化性,能够氧化硫离子;
⑤浓硫酸、浓硝酸都具有强的氧化性,常温下能够使铁铝钝化;
⑥依据阴极阳离子放电顺序解答.
解答 解:①锂与氧气反应只生成氧化锂,得不到过氧化锂,故错误;
②相同条件下,Na2CO3的溶解度大于NaHCO3,CaCO3的溶解度小于Ca(HCO3)2,故错误;
③Pb在化合物里显+2价或+4价,根据化合价代数和为零的原则写出Pb的两种氧化物形式为:PbO和PbO2,那么Pb2O3的氧化物的表示形式可以写成 2PbO•PbO2,故错误;
④Al3+与S2-在溶液中可发生双水解反应生成沉淀和气体,Fe3+和S2-发生氧化还原反应,故错误;
⑤浓硫酸、浓硝酸都具有强的氧化性,常温下能够使铁铝钝化,可以用铝制或铁制容器常温下贮运浓硫酸和浓硝酸,故正确;
⑥电解CuCl2溶液阴极析出Cu,电解AlCl3溶液阴极上析出的是氢气,故错误;
故选:A.
点评 本题考查类推这一思维方法在化学学科中的应用,属于方法与知识相结合的内容,明确物质的性质是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.已知:
①CH4(g)+4N02(g)═4NO(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4N0(g)═2N2(g)+CO2+2H2O(g)△H2=-1160KJ•mol-1
则CH4催化还原NOX的相关说法正确的是( )
①CH4(g)+4N02(g)═4NO(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4N0(g)═2N2(g)+CO2+2H2O(g)△H2=-1160KJ•mol-1
则CH4催化还原NOX的相关说法正确的是( )
| A. | 由①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(1)的△H大于△H1 | |
| B. | 等物质的量的甲烷分别发生①②反应至完全,转移的电子数不同 | |
| C. | 若用0.2 mol CH4发生上述反应还原足量的NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 LCH4还原足量的NO2至N2,整个过程中转移的电子的物质的量为16 mol |
20.下列物质属于纯净物的是( )
| A. | 碘酒 | B. | 漂白粉 | C. | 食盐水 | D. | 液氯 |
4.含有5个碳原子的饱和一元醇C5H12O的同分异构体中,能被气体成醛的有( )
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
1.下列分离与提纯的方法正确的是( )
| A. | 除去Mg粉中混有的Al粉:加入足量的氨水,过滤 | |
| B. | 除去BaCO3固体中混有的BaSO4:加入过量盐酸后,过滤、洗涤 | |
| C. | 除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 | |
| D. | 从I2的四氯化碳溶液中分离出I2:分液 |

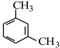 ;
;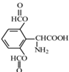 、
、 ;
; +CH3CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3CH=CH2$\stackrel{AlCl_{3}}{→}$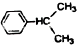 结合相关信息,请写出以
结合相关信息,请写出以 、CH2=CH2和
、CH2=CH2和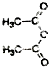 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).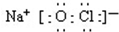 .
.