题目内容
6.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 在常温常压下,11.2 L Cl2含有的分子数为0.5NA | |
| B. | 在常温常压下,17 g NH3所含的原子数为4NA | |
| C. | 标准状况下,11.2 L CCl4所含的分子数为0.5NA | |
| D. | 56g金属铁与足量的氯气反应时,失去的电子数为2NA |
分析 A.不是标准状况,不能使用气体摩尔体积vm=22.4L/mol;
B.求出NH3的物质的量,然后根据1molNH3中含4mol原子来分析;
C.标准状况下,CCl4不是气体;
D.质量换算物质的量,结合铁和氯气反应生成的是氯化铁计算;
解答 解:A.常温下,不是标准状况下,无法使用标况下的气体摩尔体积计算11.2 L Cl2的物质的量,故A错误;
B.17gNH3的物质的量为1mol,而1molNH3中含4mol原子,即含4NA个,故B正确;
C.标准状况下,CCl4不是气体,不能使用标况下的气体摩尔体积计算CCl4的物质的量,故C错误;
D.56g金属铁物质的量为1mol,铁与氯气反应生成氯化铁,铁失去的电子数为3NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析计算,主要考查气体摩尔体积的计算应用,质量换算物质的量计算微粒数,题目较简单.

练习册系列答案
相关题目
1.下列分离与提纯的方法正确的是( )
| A. | 除去Mg粉中混有的Al粉:加入足量的氨水,过滤 | |
| B. | 除去BaCO3固体中混有的BaSO4:加入过量盐酸后,过滤、洗涤 | |
| C. | 除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 | |
| D. | 从I2的四氯化碳溶液中分离出I2:分液 |
11.将赤铜矿(Cu2O)与辉铜矿(Cu2S)混合加热发生以下反应:Cu2S+2Cu2O $\frac{\underline{\;\;△\;\;}}{\;}$ 6Cu+SO2↑,下列说法错误的是( )
| A. | 在Cu2O、Cu2S中Cu元素化合价都是+1价 | |
| B. | 反应中Cu元素被氧化,S元素被还原 | |
| C. | Cu2S在反应中既是氧化剂,又是还原剂 | |
| D. | 每生成6.4g Cu,反应中转移0.1 mole- |
3.下列各组物质中,不属于同素异形体的是( )
| A. | 晶体硅和无定形硅 | B. | 碳和二氧化碳 | ||
| C. | 木炭和活性炭 | D. | 单斜硫和斜方硫 |





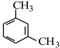 ;
;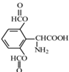 、
、 ;
; +CH3CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3CH=CH2$\stackrel{AlCl_{3}}{→}$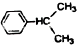 结合相关信息,请写出以
结合相关信息,请写出以 、CH2=CH2和
、CH2=CH2和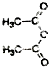 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).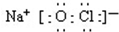 .
.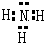 .
.