题目内容
10.下列溶液中c(Cl-)与50mL1mol•L-1的AlCl3溶液中c(Cl-)相等的是( )| A. | 150mL1mol•L-1NaCl溶液 | B. | 75mL2mol•L-1CaCl2溶液 | ||
| C. | 150mL3mol•L-1KCl溶液 | D. | 75mL3mol•L-1FeCl3溶液 |
分析 50mL1mol•L-1的AlCl3溶液中c(Cl-)=3c(AlCl3)=3×1mol/L=3mol/L,只要给予选项中c(Cl-)即符合条件,据此分析解答.
解答 解:50mL1mol•L-1的AlCl3溶液中c(Cl-)=3c(AlCl3)=3×1mol/L=3mol/L,
A.该溶液中c(Cl-)=c(NaCl)=1mol/L,故A错误;
B.该溶液中c(Cl-)=2c(CaCl2)=2×2mol/L=4mol/L,故B错误;
C.该溶液中c(Cl-)=c(KCl)=1mol/L=3mol/L,故C正确;
D.该溶液中c(Cl-)=3c(FeCl3)=3×3mol/L=9mol/L,故D错误;
故选C.
点评 本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度,为易错题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列物质属于纯净物的是( )
| A. | 碘酒 | B. | 漂白粉 | C. | 食盐水 | D. | 液氯 |
1.下列分离与提纯的方法正确的是( )
| A. | 除去Mg粉中混有的Al粉:加入足量的氨水,过滤 | |
| B. | 除去BaCO3固体中混有的BaSO4:加入过量盐酸后,过滤、洗涤 | |
| C. | 除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 | |
| D. | 从I2的四氯化碳溶液中分离出I2:分液 |
7.将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是( )
| A. | KSCN | B. | BaCl2 | C. | HCl | D. | NaOH |
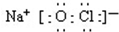 .
.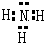 .
.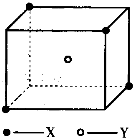 某晶体的晶胞结构如图所示.X(•)位于立方体顶点,Y(○)位于立方体中心.试分析:
某晶体的晶胞结构如图所示.X(•)位于立方体顶点,Y(○)位于立方体中心.试分析: