题目内容
1.2014年国家科学技术大会上,甲醇制取低碳烃技术(DMTO)获国家技术发明一等奖.DMTO主要包括煤的气化、液化、烯烃化三个阶段.(1)煤的气化是煤在高温下转化为水煤气的过程,主要反应方程式是C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的液化发生的主要反应如下表:
| 化学反应方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)=CH3OH(g)△H1=akJ/mol | 2.5 | 0.2 |
| ②H2(g)+CO2(g)=CO(g)+H2O(g)△H2=bkJ/mol | 1.0 | 2.3 |
| ③3H2(g)+CO2(g)=CH3OH(g)+H2O(g)△H3 | K3 | 4.6 |
②若反应①在容积为2L的密闭容器中进行,500℃测得某一时刻体系内H2、CO、CH30H物质的量分别为4、2、10,则此时生成CH30H的速率>消耗CH30H的速率(填“>”、“<”、“=”)
③K3=2.5.
(3)烯烃化阶段:图1是烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比.图中I、II表示乙烯,III表示丙烯).
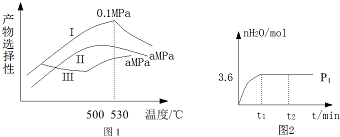
①根据图1,要尽可能多的获得乙烯,控制反应的最佳条件是530℃,0.1Mpa.
②一定温度下,某密闭容器发生如下反应:2CH3OH(g)=CH2=CH2(g)+2H2O(g),在压强为P1时,产物水的物质的量与时间的关系如图2所示,若t1时测得甲醇的体积分数是10%,此时甲醇乙烯化的转化率是85.7%(保留3位有效数字),若要提高甲醇的转化率,可采取的措施是降低压强、分离乙烯或水(写一条即可).
③若在t2时,将容器体积迅速扩大到原来的2倍,请图2中绘制出此变化发生后至反应达到新平衡时水的物质的量与时间的关系.
分析 (1)煤的气化是指煤与水蒸气反应生成CO与H2的过程.
(2)①因温度高不利于平衡向放热反应方向移动,从而导致平衡常数减小,而反应①在700℃时的平衡常数比在500℃时的平衡常数小,故①的正反应是放热反应,反应②在700℃时的平衡常数比在500℃时的平衡常数大,故②的正反应是吸热反应;依据盖斯定律,用热化学方程式①+②就可得热化学方程式③;
②依据数据计算浓度商Qc和得到的平衡常数比较判断反应进行的方向,比较甲醇的生成速率和消耗速率大小;
③依据盖斯定律,用热化学方程式①+②就可得热化学方程式③,所以反应①、②的平衡常数表达式相乘得到反应③的平衡常数;
(3)①由图1知,530℃,0.1Mpa时乙烯的选择性最大;
②t0时刻,n(H2O)=3.6mol n(CH2=CH2)=1.8mol,设甲醇起始物质的量为x mol,
2CH3OH(g)?CH2=CH2(g)+2H2O(g)
起始量(mol) x 0 0
变化量(mol) 3.6 1.8 3.6
t0时刻量(mol) x-3.6 1.8 3.6
$\frac{x-3.6}{x-3.6+1.8+3.6}$=10%,得到x计算甲醇的转化率;
根据外界条件对化学平衡的影响来解答;
③因压强变大后平衡向右移动,导致生成水的量增大,绘制图象时应注意条件改变后水的物质的量没有立即变化,重新达到平衡所需要的时间应比t3多.
解答 解:(1)煤的气化是指煤与水蒸气反应生成CO与H2的过程,反应的化学方程式为:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
故答案为:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)①因温度高不利于平衡向放热反应方向移动,从而导致平衡常数减小,而反应①在700℃时的平衡常数比在500℃时的平衡常数小,故①的正反应是放热反应,a<0;反应②在700℃时的平衡常数比在500℃时的平衡常数大,故②的正反应是吸热反应,b>0,所以△H1<△H2;
2H2(g)+CO(g)=CH3OH(g)△H1=akJ/mol ①
H2(g)+CO2(g)=CO(g)+H2O(g)△H2=bkJ/mol ②
依据盖斯定律,①+②得热化学方程式:3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=(a+b)kJ/mol;
故答案为:<;c=a+b;
②若反应①在容积为2L的密闭容器中进行,500℃测得某一时刻体系内H2、CO、CH30H物质的量分别为4、2、10,求得Qc=$\frac{C(C{H}_{3}OH)}{{C}^{2}({H}_{2})C(CO)}$=$\frac{5}{2{\;}^{2}×1}$<2.5,故此时反应向右进行,甲醇的生成速率大于其消耗速率;
故答案为:>;
③反应①、②的平衡常数相乘得到反应③的平衡常数K3=2.5×1=2.5;
故答案为:2.5;
(3)①由图1知,530℃,0.1Mpa时乙烯的选择性最大,为尽可能多地获得乙烯,控制的生产条件为530℃,0.1Mpa;
故答案为:530℃,0.1Mpa;
②t0时刻,n(H2O)=3.6mol n(CH2=CH2)=1.8mol,设甲醇起始物质的量为x mol,
2CH3OH(g)?CH2=CH2(g)+2H2O(g)
起始量(mol) x 0 0
变化量(mol) 3.6 1.8 3.6
t0时刻量(mol) x-3.6 1.8 3.6
$\frac{x-3.6}{x-3.6+1.8+3.6}$=10%,x=4.2mol则甲醇的转化率为$\frac{3.6}{4.2}$×100%=85.7%;
降低压强、分离乙烯或水,平衡正向移动,甲醇的转化率提高;
故答案为:85.7%;降低压强、分离乙烯或水;
③若在t1 时刻将容器容积快速扩大到原来的2倍,因压强变大后平衡向右移动,导致生成水的量增大,绘制图象时应注意条件改变后水的物质的量没有立即变化,重新达到平衡所需要的时间应比t3多,在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时问的关系图为: ;
;
故答案为:85.7%; .
.
点评 本题考查了化学平衡的影响因素分析,化学计算,图象的判断方法,注意平衡常数的计算应用以及平衡移动的原理,掌握基础是解题关键,题目难度中等.

①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2⑦H2S ⑧FeCl3.
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ①②③⑤⑦ | D. | ④⑥⑦⑧ |
| A. | pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① | |
| B. | 将0.5 mol/L的Na2CO3溶液与amol/L的NaHCO3溶液等体积混合,c(Na+)<c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 10mL0.1mol/LCH3COOH溶液与20mL0.1mol/LNaOH溶液混合后,溶液中离子浓度关系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 25℃某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
| A. | Mg2+、Na+、SO42- | B. | K+、H+、HCO3- | C. | Cu2+、NO3-、SO42- | D. | Ba2+、NO3-、CO32- |
| A. | 0.15mol | B. | 0.3mol | C. | 0.05mol | D. | 无法计算 |
| A. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| B. | 23g Na 与足量H2O反应完全后可生成NA个H2分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
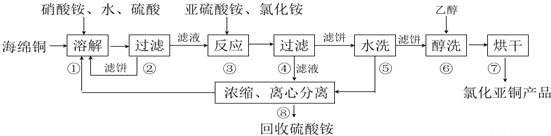
 ;
; ;
;