题目内容
17.有一包从海水获得的粗盐,已经经过初步的提纯.课外活动小组对它的成分进行探究,并将粗盐进一步提纯.探究一:这包粗盐中还有什么杂质?估计还含有氯化钙和氯化镁.
(1)现用实验验证推测:取样并溶解,加入几滴氢氧化钠溶液,目的是检验有没有氯化镁,接着再加数滴碳酸钠溶液,目的是检验有没有氯化钙.实验证明含有的杂质是氯化钙.
探究二:这包粗盐中氯化钠的质量分数是多少?接下面步骤继续实验:
①称取一定质量样品;
②将样品加水溶解;
③向粗盐溶液加入过量的某种试剂,过滤;
④沉淀洗涤后小心烘干,得到纯净固体A;
⑤滤液在进行某一操作后,移入蒸发皿蒸发,得到纯净固体B;
⑥称量实验中得到的某种固体.
(2)在②③⑤的步骤中,都使用到的同一仪器是玻璃棒,它在步骤②和⑤的操作方法相同,但目的不同,在步骤②的目的是加速溶解,步骤⑤的目的是防止液体飞溅.
(3)在步骤③中加入的试剂是碳酸钠溶液
(4)步骤⑥中,你认为需要称量的固体是A还是BA.
分析 (1)镁离子与氢氧化钠反应生成氢氧化镁沉淀,所以检验的是氯化镁;碳酸钠与钙离子反应生成碳酸钙沉淀,加入碳酸钠是用于检验氯化钙;
(2)在溶解、蒸发、过滤操作中都会用到玻璃棒,在溶解样品时使用玻璃棒搅拌,以便加速溶解;蒸发滤液时用玻璃棒搅拌,使液体受热均匀;
(3)粗盐中含有氯化钙,需要加入碳酸钠溶液,反应生成碳酸钙沉淀,从而除去杂质钙离子;
(4)根据存在步骤可知,A为碳酸钙沉淀,而B中含有反应生成的氯化钠.
解答 解:(1)氯化镁与氢氧化钠反应生成氢氧化镁沉淀,故加入氢氧化钠溶液的目的是检验溶液中是否含有氯化镁;
氯化钙与碳酸钠反应生成碳酸钙沉淀,则加入碳酸钠溶液的目的是检验溶液中是否含有氯化钙,
故答案为:氯化镁;氯化钙;
(2)②③⑤的步骤分别为溶解、过滤和蒸发操作,三种操作中都使用到玻璃棒,它在步骤②和⑤的操作方法都是搅拌,但目的不同,在步骤②的目的是加速固体的溶解,步骤⑤的目的是使液体受热均匀,避免液体飞溅,
故答案为:玻璃棒;加速溶解;防止液体飞溅;
(3)已知粗盐溶液中含有氯化钙,即含有杂质钙离子,应该加入碳酸钠溶液除去,
故答案没玩:碳酸钠溶液;
(4)A为反应生成碳酸钙的质量,可以据此计算出氯化钙的质量,从而计算出氯化钠的质量分数;而B中含有新生成的氯化钠,无法计算氯化钠的质量分数,所以步骤⑥中需要称量的是A的质量,
故答案为:A.
点评 本题考查了粗盐的提纯方法、性质实验方案的设计与评价,题目难度不大,注意掌握物质分离与提纯方法,正确理解提纯原理为解答本题的关键,试题有利于培养学生的分析、理解能力及化学实验能力.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
7.下列说法不正确的是( )
| A. | 按照系统命名法,烃分子 的名称为2,3-二甲基-3-乙基戊烷 的名称为2,3-二甲基-3-乙基戊烷 | |
| B. | 鸡蛋白、大豆蛋白等蛋白质可溶于水,在这些蛋白质溶液中加入(NH4)2SO4或Na2SO4的浓溶液,可使蛋白质的溶解度降低而析出 | |
| C. | 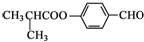 可发生加成反应、取代反应、氧化反应 可发生加成反应、取代反应、氧化反应 | |
| D. | 有机物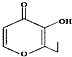 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 |
5.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① | |
| B. | 将0.5 mol/L的Na2CO3溶液与amol/L的NaHCO3溶液等体积混合,c(Na+)<c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 10mL0.1mol/LCH3COOH溶液与20mL0.1mol/LNaOH溶液混合后,溶液中离子浓度关系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 25℃某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
12.如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法正确的是( )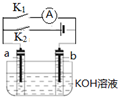

| A. | 断开K2,闭合K1一段时间,溶液的pH要变大 | |
| B. | 断开K1,闭合K2时,b极上的电极反应式为 2H++2e-═H2↑ | |
| C. | 断开K1,闭合K2时,OH-向b极移动 | |
| D. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O |
13.溶解了三种正盐的混合溶液中含有0.2molNa+、0.25molMg2+,0.4molCl-,则还含有的另一种离子SO42-为( )
| A. | 0.15mol | B. | 0.3mol | C. | 0.05mol | D. | 无法计算 |
14.在t℃时,将a gNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg/cm3,质量分数为w,其中含NH4+的物质的量为b mol.下列叙述中正确的是( )
| A. | 溶质的质量分数w=$\frac{1000a}{17V}$100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ (mol/L) | |
| C. | 溶液中c(OH-)=$\frac{b}{V}$ (mol/L) | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w |
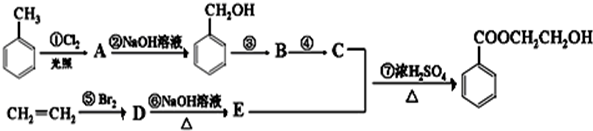
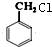 .
.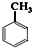 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$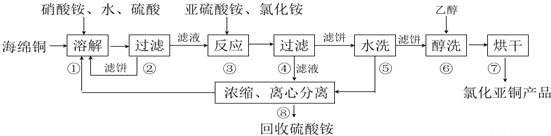
 ;
;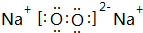 ;
;