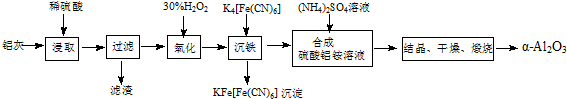
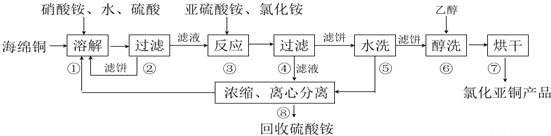
题目内容
12.Ⅰ.锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用.工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌: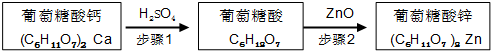
步骤1:充分反应后,过滤除去CaSO4沉淀.
步骤2:将葡萄糖酸溶液与ZnO混合.
(1)步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解.
(2)下列物质可替代ZnO的是b、e(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4e.ZnCO3.
Ⅱ.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→(C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
 请回答下列问题:
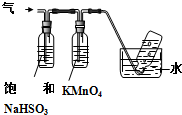
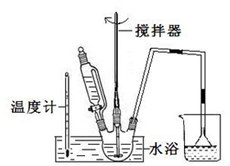
请回答下列问题:(3)第①步中溴水氧化葡萄糖可以用如图装置,其中水浴加热的原因是溶液受热均匀,且便于控制温度
(4)第②步中所加CaCO3还发生了其他反应,写出其中一个主要反应的方程式CaCO3+2HBr=CaBr2+CO2↑+H2O;
(5)第③步需趁热过滤,原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(6)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
分析 (1)须继续加入葡萄糖酸溶液至pH为5.8,抑制锌离子水解;
(2)步骤2为ZnO与葡萄糖酸的反应生成葡萄糖酸锌,不能引入新杂质,则加入不溶性含Zn元素的物质,且与酸反应即可;
(3)第①步反应的温度为55℃,所以可以用水浴加热的方式;
(4)碳酸钙能与氢溴酸反应生成溴化钙、水和二氧化碳;CaCO3固体需有剩余,可使葡萄糖酸完全反应;
(5)趁热过滤,可避免葡萄糖酸钙的损失;由表中数据可知,葡萄糖酸钙微溶于乙醇,可避免损失;
(6)洗涤沉淀,应避免沉淀溶解,且能将沉淀吸附物冲洗去.
解答 解:(1)因锌离子水解,则步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解,
故答案为:抑制Zn2+的水解;
(2)a.NH3•H2O与葡萄糖酸反应后引入铵根离子,故不选;
b.Zn(OH)2 与葡萄糖反应生成葡萄糖酸锌,且不引人杂质,故选;
c.NaOH与葡萄糖酸反应后引入钠离子,故不选;
d.ZnSO4与葡萄糖酸不反应,故不选;
e.ZnCO3与葡萄糖反应生成葡萄糖酸锌,且不引人杂质,故选;
故答案为:b、e;
(3)第①步反应的温度为55℃,所以可以用水浴加热的方式,水浴加热可使溶液受热均匀,且便于控制温度,
故答案为:溶液受热均匀,且便于控制温度;
(4)碳酸钙能与氢溴酸反应生成溴化钙、水和二氧化碳,CaCO3+2HBr=CaBr2+CO2↑+H2O,
故答案为:CaCO3+2HBr=CaBr2+CO2↑+H2O;
(5)温度高时,葡萄糖酸钙的溶解度较大,趁热过滤,可避免葡萄糖酸钙的损失,由表中数据可知,葡萄糖酸钙微溶于乙醇,用乙醇洗涤可避免损失,有利于葡萄糖酸钙析出,
故答案为:葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(6)洗涤沉淀,应避免沉淀溶解,且能将沉淀吸附物冲洗去,可用乙醇-水混合溶液,如只用水,则造成葡萄糖酸钙溶解而损失,只用乙醇,不能将杂质全被洗去;故答案为:D.
点评 本题考查物质的分离提纯的方法及选择,为高频考点,把握物质的性质及性质差异、发生的反应为解答的关键,侧重盐类水解、除杂及分析应用能力的考查,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 标准状况下,1 mol NO与0.5 mol O2混合后气体的体积为22.4 L | |
| B. | 1L 0.5 mol•L-1 NaF溶液中含有的F-数目为0.5NA | |
| C. | 7.8g Na2S和Na2O2晶体混合物中共含有0.1NA个阴离子 | |
| D. | 12g石墨晶体中正六边形的数目为3NA |
| A. | 向 AlCl3溶液中滴加浓氨水至过量:Al3++4OH-═AlO2-+2H2O | |
| B. | 漂白粉溶液中通入过量SO2:ClOˉ+H2O+SO2═HSO3-+HClO | |
| C. | CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 在澄清石灰水中加入少量小苏打溶液:Ca2++OHˉ+HCO3-═CaCO3↓+H2O |
| A. | 三种一元弱酸HX、HY、HZ,其电离平衡常数依次减小,则同体积同pH的对应钠盐溶液中,水的电离度大小是NaX>NaY>NaZ | |
| B. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)=c( H+)+c(CH3COOH) | |
| C. | 0.1mol/LNaHS溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c( S2-)>c(HS-)>c(OH-) | |
| D. | 向0.01mol/L的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)=c( SO42-)>c(NH4+)>c(H+)=c(OH-) |
| A. | 按照系统命名法,烃分子 的名称为2,3-二甲基-3-乙基戊烷 的名称为2,3-二甲基-3-乙基戊烷 | |
| B. | 鸡蛋白、大豆蛋白等蛋白质可溶于水,在这些蛋白质溶液中加入(NH4)2SO4或Na2SO4的浓溶液,可使蛋白质的溶解度降低而析出 | |
| C. | 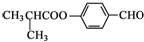 可发生加成反应、取代反应、氧化反应 可发生加成反应、取代反应、氧化反应 | |
| D. | 有机物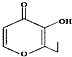 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 |
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2⑦H2S ⑧FeCl3.
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ①②③⑤⑦ | D. | ④⑥⑦⑧ |
| A. | 加入反应物,使活化分子的百分数增加,反应速率加快 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小体积)可增加活化分子的百分数使化学反应速率增大 | |
| C. | 升高温度使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 活化分子间发生的碰撞为有效碰撞 |