题目内容
4.下列分子中的中心原子杂化轨道的类型相同的是( )| A. | CH4与NH3 | B. | BeCl2与BF3 | C. | CO2与H2O | D. | C2H2与C2H4 |
分析 根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.
解答 解:A.CH4中C形成4个σ键,无孤电子对,为sp3杂化,NH3中N形成3个σ键,孤电子对数=$\frac{5-3×1}{2}$=1,为sp3杂化,相同,故A正确;
B.BeCl2中Be原子杂化轨道数为$\frac{1}{2}$(2+2)=2,采取 sp杂化方式,BF3中B原子杂化轨道数为$\frac{1}{2}$(3+3)=3,采取 sp2杂化方式,二者杂化方式不同,故B错误;
C.CO2中C原子杂化轨道数为$\frac{1}{2}$×(4+0)=2,采取sp杂化方式,水分子中O原子价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,所以采用sp3杂化,二者杂化方式不同,故C错误;
D.C2H2分子中碳原子形成1个C-H,1个C≡C三键,C原子杂化轨道数为(1+1)=2,采取 sp杂化方式,C2H4分子中碳原子形成2个C-H,1个C═C双键,C原子杂化轨道数为(2+1)=3,C原子采取sp2杂化方式,两者中心原子杂化轨道的类型不同,故D错误;
故选A.
点评 本题考查原子杂化方式判断,为高频考点,明确价层电子对互斥理论即可解答,难点是孤电子对计算方法,题目难度中等.

练习册系列答案
相关题目
15. 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的实验装置如下:实验中可能用到的数据如表:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的实验装置如下:实验中可能用到的数据如表:
①合成反应:在仪器B中加入适量NaBr、浓硫酸和50ml乙醇,安装好仪器,缓缓加热,收集馏出物.
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)仪器B的名称是蒸馏烧瓶,B中发生的主要反应有:NaBr+H2SO4=NaHSO4+HBr,以及HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O
(2)仪器C为直形冷凝管,冷水进口是b(填“a”或“b”)
(3)仪器D置于盛有冰水混合的烧杯中,目的是冷却溴乙烷
(4)溴乙烷粗产品分离提纯阶段,加水的目的是除去溶解在溴乙烷中乙醇
(5)该实验所得溴乙烷的产率为79%.
 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的实验装置如下:实验中可能用到的数据如表:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的实验装置如下:实验中可能用到的数据如表:| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)仪器B的名称是蒸馏烧瓶,B中发生的主要反应有:NaBr+H2SO4=NaHSO4+HBr,以及HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O
(2)仪器C为直形冷凝管,冷水进口是b(填“a”或“b”)
(3)仪器D置于盛有冰水混合的烧杯中,目的是冷却溴乙烷
(4)溴乙烷粗产品分离提纯阶段,加水的目的是除去溶解在溴乙烷中乙醇
(5)该实验所得溴乙烷的产率为79%.
12.下列关于金属的叙述正确的是( )
| A. | 金属元素在不同化合物中的化合价均不同 | |
| B. | 金属一定具有良好的导电性、导热性和延展性 | |
| C. | 金属单质在化学反应中化合价一定升高,作还原剂 | |
| D. | 常温下,所有金属都能与酸反应 |
19.将NaOH溶液和CuSO4溶液加入到某病人的尿液中,微热,有砖红色沉淀生成.由此可以得知该病人的尿液中含有( )
| A. | 食醋 | B. | 酒精 | C. | 食盐 | D. | 葡萄糖 |
9.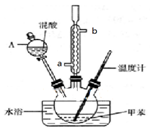 某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):
某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):
反应原理: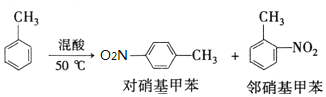
实验中可能用到的数据:
实验步骤:
①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15g.
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许沸石(或碎瓷片),目的是防止暴沸.
(2)冷凝管的作用是冷凝回流;冷却水从冷凝管的a(填“a”或“b”)端进入.
(3)仪器A的名称是分液漏斗,使用该仪器前必须进行的操作是检查是否漏液.
(4)分离反应后产物的方案如下:

其中,操作1的名称为分液,操作2必需的玻璃仪器有6种
(5)本实验中一硝基甲苯的产率为77.5%(已知:甲苯的分子量为92,一硝基甲苯的分子量为137,结果保留小数点后一位数字).
 某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):
某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):反应原理:

实验中可能用到的数据:
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15g.
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许沸石(或碎瓷片),目的是防止暴沸.
(2)冷凝管的作用是冷凝回流;冷却水从冷凝管的a(填“a”或“b”)端进入.
(3)仪器A的名称是分液漏斗,使用该仪器前必须进行的操作是检查是否漏液.
(4)分离反应后产物的方案如下:

其中,操作1的名称为分液,操作2必需的玻璃仪器有6种
(5)本实验中一硝基甲苯的产率为77.5%(已知:甲苯的分子量为92,一硝基甲苯的分子量为137,结果保留小数点后一位数字).
16.25℃时,下列溶液中各离子的浓度关系正确的是( )
| A. | 0.1mol•L-1的CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)>0.1mol•L-1 | |
| B. | 等物质的量浓度的Na2CO3溶液与NaHCO3溶液相比,前者的c(H+)更小 | |
| C. | pH=9.4,浓度均为0.1mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) | |
| D. | 将少量AgCl分别加入等体积等物质的量浓度的NaBr溶液与KI溶液中,充分反应后,后者的c(Ag+)更大 |
13.下列说法中,正确的是( )
| A. | 烃和卤代烃都不溶于水,且密度比水小 | |
| B. | 沸点由高到低顺序为CH3CH2CH2Br>CH3CH2Br>CH3CH2Cl>CH3CH3 | |
| C. | CH3Cl、 、CH3CH2Br都能发生水解反应和消去反应 、CH3CH2Br都能发生水解反应和消去反应 | |
| D. | CH3CH2I与酸化的AgNO3溶液反应会产生黄色沉淀 |

