题目内容
5.2016年9月3日,二十国集团领导人杭州峰会之前,中国政府率先签署了《巴黎协定》并向联合国交存批准文书,体现中国为应对全球气候变化做出了重要贡献.为减少CO2对环境造成影响,有科学家提出设想,先把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇,流程如图1所示:
(1)写出分解池中反应的化学方程式2KHCO3$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+H2O+CO2↑.
(2)在合成塔中,当有8.8gCO2与足量H2完全反应,可放出9.84×l03kJ的能量,写出合成塔中反应的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49200KJ/mol.
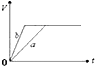
(3)在体积为l L的密闭容器中,充入1molCO2和3molH2在300℃下发生反应,有关物质的浓度随时间变化如图2所示.
①从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol/(L•min).
②其他条件不变,只将温度提高到500℃,再次平衡时n(CH3OH)/n(CO2)比值减小(填“增大”、“减小”或“不变”).
③从平衡移动原理分析,低温有利于提高原料气的转化率,而实际生产中采用300℃的温度,原因是催化剂此温度下活性最大.
(4)目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是bd.
a.容器中密度不变
b.单位时间内消耗2molCO2,同时消耗1mol二甲醚
c.v(CO2):v(H2)=1:3
d.容器内压强保持不变.
分析 (1)碳酸氢钾不稳定,加热时分解生成碳酸钾和二氧化碳、水;
(2)8.8gCO2的物质的量=$\frac{8.8g}{44g/mol}$=0.2mol,0.2mol二氧化碳和足量氢气反应放出9.84×l03kJ热量,计算1mol二氧化碳与足量氢气反应放出的热量,从而写出其热化学反应方程式;
(3)①依据化学反应速率的概念计算,用单位时间内物质浓度的变化计算得到;
②反应是放热反应温度升高平衡逆向进行;
③考虑反应快慢(或者催化剂活性);
(4)化学平衡状态的标志是正逆反应速率相同,各组分浓度保持不变,分析选项判断.
解答 解:(1)二氧化碳和饱和的碳酸钾溶液反应生成碳酸氢钾,碳酸氢钾不稳定,加热时分解生成碳酸钾、二氧化碳和水,所以方程式为2KHCO3$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+H2O+CO2↑.
故答案为:2KHCO3$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+H2O+CO2↑;
(2)8.8gCO2的物质的量=$\frac{8.8g}{44g/mol}$=0.2mol,0.2mol二氧化碳和足量氢气反应放出9.84×l03kJ热量,计算1mol二氧化碳与足量氢气反应放出的热量为49200KJ:,所以其热化学反应方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49200KJ/mol,
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49200KJ/mol;
(3)①图象分析,甲醇表示的反应速率=$\frac{0.75mol/L}{10min}$=0.075mol/L•min;依据化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)计算得到氢气表示的反应速率=0.075mol/L•min×3=0.225 mol/(L•min);
故答案为:0.225 mol/(L•min);
②反应是放热反应,若其它条件不变,只将温度提高到800℃,平衡逆向进行,再次达平衡时$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$比值减小;
故答案为:减小;
③从平衡移动原理分析,低温有利于提高原料气的转化率,而实际生产中采用300℃的温度是为了催化剂此温度下活性最大,
故答案为:催化剂此温度下活性最大;
根据:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0可知,该反应为气体体积减小的吸热反应,所以在一定温度下,体积恒定的密闭容器中,
a.反应前后气体质量守恒,体积固定,所以过程中密度不变,容器的密度不变不能证明反应达到平衡,故a错误;
b.单位时间内消耗2mol CO2,同时消耗1mol二甲醚证明反应的正逆反应速率相同,能说明反应达到平衡,故b正确;
c.v(CO2):v(H2)=1:3无法判断正逆反应速率是否相等,故c错误;
d.反应前后气体体积变化,容器内压强保持不变说明反应达平衡状态,故d正确;
故答案为:bd.
点评 本题考查了工业制备物质的原理应用,热化学方程式的书写方法和注意问题,化学反应速率计算和平衡影响因素的理解,题目难度中等.

| A. | NaOH溶液 | B. | Na2CO3溶液 | ||
| C. | 石蕊试液 | D. | 新制的Cu(OH)2悬浊液 |
 下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )
下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )| X | Y | Z | |
| A | SO2 | CO | CaCl2 |
| B | NH3 | CO2 | Al2(SO4)3 |
| C | NO2 | SO2 | BaCl2 |
| D | Cl2 | O2 | Na2S |
| A. | A | B. | B | C. | C | D. | D |
| A. | NaAlO2和HCl | B. | NaOH和NaHCO3 | C. | CO2和NaOH | D. | Na2CO3和HCl |
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 中和热测定实验中,若用铜质搅拌器,则所测中和热的绝对值偏大 | |
| C. | 利用油脂在碱性条件下的水解,可以制甘油和肥皂 | |
| D. | 蛋白质属于天然高分子化合物,盐酸可以使蛋白质变黄,称为颜色反应 |
| A. | CH4与NH3 | B. | BeCl2与BF3 | C. | CO2与H2O | D. | C2H2与C2H4 |
 A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).
A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).