题目内容
5.下列各化合物的命名正确的是( )| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. |  2-甲基丁烷 2-甲基丁烷 |
分析 A.含2个碳碳双键,为二烯烃;
B.为乙酸与乙二醇以2:1发生酯化反应生成的酯;
C.含-OH的主链有4个C,-OH在2号C上;
D. 中主链含4个C,2号C上有甲基.
中主链含4个C,2号C上有甲基.
解答 解:A.含2个碳碳双键,为二烯烃,则CH2=CH-CH=CH2的名称为1,3-丁二烯,故A错误;
B.为乙酸与乙二醇以2:1发生酯化反应生成的酯,则CH3COOCH2CH2OOCCH3的名称为二乙酸乙二酯,故B错误;
C.含-OH的主链有4个C,-OH在2号C上,则CH3CH2CH(OH)CH3的名称为2-丁醇,故C错误;
D. 中主链含4个C,2号C上有甲基,其名称为2-甲基丁烷,故D正确;
中主链含4个C,2号C上有甲基,其名称为2-甲基丁烷,故D正确;
故选D.
点评 本题考查有机物物的命名,为高频考点,把握选主链子、定位次、写名称的方法命名有机物为解答的关键,侧重分析与应用能力的考查,选项B为易错点,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
15. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
(1)该滴定实验终点的现象时当最后一滴标准液滴下,锥形瓶中溶液的颜色由红变无色,半分钟内颜色不再变化.
(2)滴定时边滴边摇动形瓶,眼睛应注视锥形瓶内溶液颜色的变化;
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(填偏高、偏低或无影响);
(4)步骤②缺少的操作是用盐酸标准液润洗酸式滴定管;
(5)如图,是某次滴定滴定管中的液面,其读数为27.20mL
(6)根据下列数据:
请选用合理的数据计算待测烧碱溶液的浓度为0.0800 mol/L
(7)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
(1)该滴定实验终点的现象时当最后一滴标准液滴下,锥形瓶中溶液的颜色由红变无色,半分钟内颜色不再变化.
(2)滴定时边滴边摇动形瓶,眼睛应注视锥形瓶内溶液颜色的变化;
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(填偏高、偏低或无影响);
(4)步骤②缺少的操作是用盐酸标准液润洗酸式滴定管;
(5)如图,是某次滴定滴定管中的液面,其读数为27.20mL
(6)根据下列数据:
| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
| 第三次 | 25.00 | 0.80 | 23.10 |
(7)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数.
13.以锌锰废电池中的碳包为原料回收MnO2的过程中涉及如下反应:
①MnO2(s)+C(s)═MnO(s)+CO(g)△H1=+24.4kJ•mol-1
②MnO2(s)+CO(g)═MnO(s)+CO2(g)△H2=-148.1kJ•mol-1
③2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H3
则下列判断正确的是( )
①MnO2(s)+C(s)═MnO(s)+CO(g)△H1=+24.4kJ•mol-1
②MnO2(s)+CO(g)═MnO(s)+CO2(g)△H2=-148.1kJ•mol-1
③2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H3
则下列判断正确的是( )
| A. | 碱性锌锰干电池属于二次电池 | B. | △H3=△H1+△H2 | ||
| C. | 反应①的活化能为24.4 kJ•mol-1 | D. | △H1<△H3 |
20.能正确表示下列反应的离子方程式的是( )
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | 氯化钠与浓硫酸混合加热:H++Cl-$\frac{\underline{\;\;△\;\;}}{\;}$HCl↑ | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
10.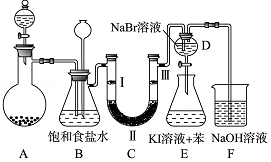 如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象长颈漏斗中发生倒吸,液面上升.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入D
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,溶液中发生的反应方程式为Cl2+2NaBr=Br2+2NaCl;打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象溶液分层,上层为紫色溶液,下层为无色液体.说明氯、溴、碘单质的氧化性强弱顺序为Cl2>Br2>I2.
 如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象长颈漏斗中发生倒吸,液面上升.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入D
| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
17.铜及其化合物在工农业生产及日常生活中应用非常广泛.回答下列问题:
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如表所示.
①方法I中还原剂与氧化剂的物质的量之比为1:4.
②方法II发生反应的化学方程式为4Cu(OH)2+N2H4=Cu2O+N2↑+6H2O.
(2)氢化亚铜是一种红色同体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示.
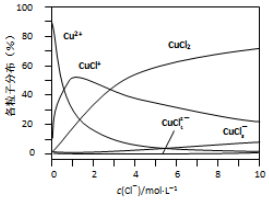
①当c(C1-)=9mol/L时,溶液中3种主要含铜微粒浓度的大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(C1-)=l mol/L的氯化铜溶液中,加人AgNO3溶液,CuCl+转化为Cu2+的离子方程式为CuCl++Ag+=Cu2++AgCl↓.
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp=2.0×10-20.则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9.
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如表所示.
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
②方法II发生反应的化学方程式为4Cu(OH)2+N2H4=Cu2O+N2↑+6H2O.
(2)氢化亚铜是一种红色同体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示.

①当c(C1-)=9mol/L时,溶液中3种主要含铜微粒浓度的大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(C1-)=l mol/L的氯化铜溶液中,加人AgNO3溶液,CuCl+转化为Cu2+的离子方程式为CuCl++Ag+=Cu2++AgCl↓.
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp=2.0×10-20.则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9.
14.表中对离子方程式的正误判断及改正方法均正确的是( )
| 选项 | 化学反应 | 离子方程式 | 判断及改正方法 |
| A | CaCO3和醋酸溶液反应 | CaCO3+2H+═Ca2++H2O+CO2↑ | 正确 |
| B | 向Ba(OH)2溶液中加H2SO4溶液 | Ba2++OH-+H++SO42-═BaSO4↓+H2O | 错误:OH-、H+、H2O的化学计量数应均为2 |
| C | 过量的浓氨水加入到AlCl3溶液中 | Al3++3NH3•H2O═3NH4++Al(OH)3↓ | 错误:应生成AlO2-、NH4+、H2O |
| D | 将铜片插入硝酸银溶液中 | Cu+Ag+═Cu2++Ag | 正确 |
| A. | A | B. | B | C. | C | D. | D |





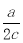 L C.ac L D.2ac L
L C.ac L D.2ac L