题目内容
某课外小组利用如图装置在实验室制取SO2并探究其有关性质:
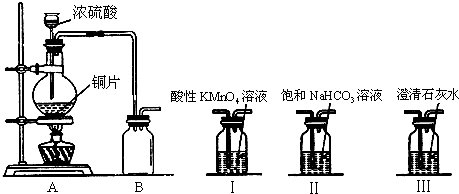
根据上图回答下列问题:
(1)装置A中存在一处错误,改正这处错误 .
(2)写出装置A中发生反应的化学方程式 ,B瓶起的作用为 .
(3)为了探究亚硫酸的酸性比碳酸酸性强的性质,有同学甲在装置B的出气口先连接装置Ⅱ,再连接装置Ⅰ,然后连接装置Ⅲ.装置Ⅰ的作用是 ,装置Ⅲ中出现的实验现象为 .
(4)同学乙认为同学甲的装置连接中不足以说明装置Ⅲ中的现象是二氧化碳所为,请说出理由 ,在不增加其他装置和试剂,装置Ⅰ、Ⅱ、Ⅲ可以重复使用的前提下,请提出修改方案,在修改方案中,装置Ⅰ、Ⅱ、Ⅲ的连接顺序为 (用“Ⅰ→Ⅱ→Ⅲ”的形式表示).

根据上图回答下列问题:
(1)装置A中存在一处错误,改正这处错误
(2)写出装置A中发生反应的化学方程式
(3)为了探究亚硫酸的酸性比碳酸酸性强的性质,有同学甲在装置B的出气口先连接装置Ⅱ,再连接装置Ⅰ,然后连接装置Ⅲ.装置Ⅰ的作用是
(4)同学乙认为同学甲的装置连接中不足以说明装置Ⅲ中的现象是二氧化碳所为,请说出理由
考点:性质实验方案的设计
专题:
分析:(1)A装置生成的气体容易从从长颈漏斗中逸出;
(2)烧瓶中Cu与浓硫酸反应生成二氧化硫、硫酸铜和水;二氧化硫易溶于水,要防倒吸;
(3)用KMnO4溶液吸收多余的二氧化硫;用澄清石灰水检验二氧化碳;
(4)要验证酸性:H2SO3>H2CO3,则二氧化硫应该先通入NaHCO3溶液,然后用KMnO4溶液吸收多余的二氧化硫,要检验二氧化硫是否除净.
(2)烧瓶中Cu与浓硫酸反应生成二氧化硫、硫酸铜和水;二氧化硫易溶于水,要防倒吸;
(3)用KMnO4溶液吸收多余的二氧化硫;用澄清石灰水检验二氧化碳;
(4)要验证酸性:H2SO3>H2CO3,则二氧化硫应该先通入NaHCO3溶液,然后用KMnO4溶液吸收多余的二氧化硫,要检验二氧化硫是否除净.
解答:
解:(1)A装置是二氧化硫的发生装置,装置生成的气体容易从从长颈漏斗中逸出,所以应该把长颈漏斗改为分液漏斗,
故答案为:把长颈漏斗改为分液漏斗;
(2)烧瓶中Cu与浓硫酸反应生成二氧化硫、硫酸铜和水,其反应方程式为:2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O;二氧化硫易溶于水,要防倒吸,B瓶能防止后面的液体倒吸进入A装置,所以B瓶作安全瓶,防止发生倒吸;
故答案为:2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O;安全瓶,防止发生倒吸;
(3)要验证酸性:H2SO3>H2CO3,则二氧化硫应该先通入NaHCO3溶液,然后用KMnO4溶液吸收多余的二氧化硫,则I的作用是除去剩余的SO2,最后用澄清石灰水检验二氧化碳,则装置Ⅲ中出现白色浑浊;
故答案为:除去剩余的SO2;出现白色浑浊;
(4)要验证酸性:H2SO3>H2CO3,则二氧化硫应该先通入NaHCO3溶液,然后用KMnO4溶液吸收多余的二氧化硫,但是不能确定二氧化硫是否除净,所以在通入装置Ⅲ之前不能说明气体中是否存在SO2,所以再用高锰酸钾溶液检验二氧化硫是否除净,即在I和III之间再加一个盛有高锰酸钾溶液的洗气瓶,则仪器链接顺序为:II→I→I→Ⅲ,
故答案为:在通入装置Ⅲ之前不能说明气体中是否存在SO2;II→I→I→Ⅲ.
故答案为:把长颈漏斗改为分液漏斗;
(2)烧瓶中Cu与浓硫酸反应生成二氧化硫、硫酸铜和水,其反应方程式为:2H2SO4(浓)+Cu
| ||
故答案为:2H2SO4(浓)+Cu
| ||
(3)要验证酸性:H2SO3>H2CO3,则二氧化硫应该先通入NaHCO3溶液,然后用KMnO4溶液吸收多余的二氧化硫,则I的作用是除去剩余的SO2,最后用澄清石灰水检验二氧化碳,则装置Ⅲ中出现白色浑浊;
故答案为:除去剩余的SO2;出现白色浑浊;
(4)要验证酸性:H2SO3>H2CO3,则二氧化硫应该先通入NaHCO3溶液,然后用KMnO4溶液吸收多余的二氧化硫,但是不能确定二氧化硫是否除净,所以在通入装置Ⅲ之前不能说明气体中是否存在SO2,所以再用高锰酸钾溶液检验二氧化硫是否除净,即在I和III之间再加一个盛有高锰酸钾溶液的洗气瓶,则仪器链接顺序为:II→I→I→Ⅲ,
故答案为:在通入装置Ⅲ之前不能说明气体中是否存在SO2;II→I→I→Ⅲ.
点评:本题考查了二氧化硫、二氧化碳的性质,涉及试剂的选择、方程式的书写、气体的检验、实验方案的评价等,考查知识点较多,难度中等,注意把握二氧化硫和二氧化碳的性质和检验方法.

练习册系列答案
相关题目
下列不属于四种基本反应类型,但属于氧化还原反应的是( )
| A、Fe+H2SO4═FeSO4+H2↑ | ||||
B、CO+CuO
| ||||
C、Cu2(OH)2CO3
| ||||
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
甲溶液的pH=3,乙溶液的pH=6,则下列说法正确的是( )
| A、甲、乙两溶液均呈酸性 |
| B、甲、乙两溶液中c(H+)之比为1:2 |
| C、甲、乙两溶液中水的电离程度大小无法比较 |
| D、甲中水的电离程度小于乙中水的电离程度 |
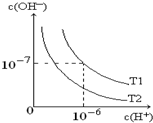 如图是在温度T1、T2时溶液中c(H+)、c(OH-)变化关系图,试回答:
如图是在温度T1、T2时溶液中c(H+)、c(OH-)变化关系图,试回答:
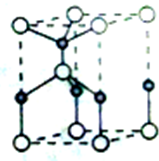 利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为
利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题: