题目内容
在KCl和CaCl2的混合物中,K+和Ca2+的物质的量之比为2:1,则该混合物中CaCl2的质量分数是多少?二者的物质的量之比为多少?含1mol Cl-的混合物的质量是多少克?
考点:物质的量的相关计算,溶液中溶质的质量分数及相关计算
专题:
分析:由化学式可知n(KCl)=n(K+),n(CaCl2)=n(Ca2+),据此判断KCl与CaCl2的物质的量之比,令氯化钙的物质的量为xmol,则氯化钾为2xmol,根据氯离子列方程计算x的值,进而计算各自的物质的量,再根据m=nM计算质量,进而计算总质量.
解答:
解:由化学式可知n(KCl)=n(K+),n(CaCl2)=n(Ca2+),故n(KCl):n(CaCl2)=n(K+):n(Ca2+)=2:1,令氯化钙的物质的量为xmol,则氯化钾为2xmol,根据氯离子可知,2x+2x=1,解得x=0.25,故m(KCl)=0.25mol×2×74.5mol/L=37.25g,m(CaCl2)=0.25mol×111g/mol/L=27.75g,CaCl2的质量分数为:
×100%=42.7%,故含1mol氯离子的该混合物的质量为37.25g+27.75g=64.5g;
答:该混合物中CaCl2的质量分数是42.7%;二者的物质的量之比为2:1;含1mol Cl-的混合物的质量是64.5g;
| 27.75g |
| 27.75g+37.25g |
答:该混合物中CaCl2的质量分数是42.7%;二者的物质的量之比为2:1;含1mol Cl-的混合物的质量是64.5g;
点评:本题考查混合物的有关计算,比较基础,注意基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
常温下在20mL 0.l mol?L-1 Na2A溶液(pH=11)中逐滴加入0.1mol/L的盐酸,溶液的pH逐渐降低,下列说法一定正确的是(NA表示阿伏加德罗常数)( )
| A、当盐酸加入10mL时,溶液中c(Na+)=2 c(HA-)+2c(A2-)+2 c(H2A) |
| B、当盐酸加入20mL时,溶液中c(Na+)>c(Cl-)>c(HA-)>c(H+)>c(OH-) |
| C、当盐酸加入20mL时,溶液中HA-的数目小于0.002NA |
| D、当盐酸加入40mL时,溶液中c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)+c(Cl-) |
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍.下列说法正确的是( )
| A、微粒半径:Z2+>W2->R- |
| B、对应氢化物的稳定性:W>R |
| C、W与X、W与Z形成的化学物晶体类型相同 |
| D、Y的最高价氧化物对应的水化物是弱酸 |
从溴乙烷制取1,2-二溴乙烷,下列转化方案中最好的是( )
A、CH3CH2Br
 | |||||||
B、CH3CH2Br
| |||||||
C、CH3CH2Br
| |||||||
D、CH2=CH2
|
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
| A、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B、1molH2O含有的原子数目为3NA |
| C、常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
| D、常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA |
下列各溶液中氯离子(Cl-)的物质的量浓度最大的是( )
| A、200 mL,0.5mol?L-1的NaCl溶液 |
| B、100 mL,0.5mol?L-1的MgCl2溶液 |
| C、150 mL,1mol?L-1的NaCl溶液 |
| D、50 mL,0.5mol?L-1的AlCl3溶液 |
下列各组中的两物质相互反应时,与反应条件和用量无关的是( )
| A、Na和O2 |
| B、Fe和FeCl3 |
| C、CO2和NaOH |
| D、AlCl3和NaOH |
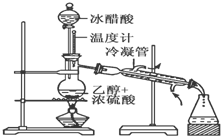 实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)