题目内容
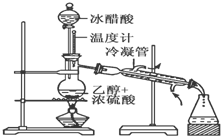 实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:
(3)在该实验中,若用1mol乙醇和1mol乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?
考点:乙酸乙酯的制取
专题:
分析:(1)对于液体加热蒸馏,应加入碎瓷片,防止暴沸;
(2)浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅;
(3)乙酸和乙醇生成乙酸乙酯的反应属于可逆反应,反应物不可能完全转化成生成物.
(2)浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅;
(3)乙酸和乙醇生成乙酸乙酯的反应属于可逆反应,反应物不可能完全转化成生成物.
解答:
解:(1)给混合液体加热时,需要加入碎瓷片,目的是防止暴沸,故答案为:防止暴沸;
(2)浓硫酸密度大,混合中放出大量热,为防止酸液飞溅,应将浓硫酸慢慢加入到密度小的乙醇中,边加边振荡,故答案为:先在烧瓶中加入一定量的乙醇,然后慢慢将浓硫酸加入烧瓶,边加边振荡;
(3)乙酸和乙醇生成乙酸乙酯的反应属于可逆反应,反应不能进行完全,则生成的乙酸乙酯的物质的量一定小于1mol,故答案为:否;该反应是可逆反应,反应不能进行完全.
(2)浓硫酸密度大,混合中放出大量热,为防止酸液飞溅,应将浓硫酸慢慢加入到密度小的乙醇中,边加边振荡,故答案为:先在烧瓶中加入一定量的乙醇,然后慢慢将浓硫酸加入烧瓶,边加边振荡;
(3)乙酸和乙醇生成乙酸乙酯的反应属于可逆反应,反应不能进行完全,则生成的乙酸乙酯的物质的量一定小于1mol,故答案为:否;该反应是可逆反应,反应不能进行完全.
点评:本题考查乙酸乙酯的制取方法,注意掌握乙酸乙酯的制备方法及反应原理,明确正确的实验操作方法,试题有利于培养学生的分析、理解能力.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
室温下,下列溶液中粒子的物质的量浓度关系正确的是( )
| A、O.lmol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(0H-) |
| B、O.lmol/L Na2C03溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.lmol/L |
| C、pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| D、浓度均为0.1 mol/L的①NH4Cl②NH4Al(SO4)2③NH4HCO3三种溶液,其中c(NH4+):③>①>② |
下列关于氯的说法错误的是( )
| A、氯水、液氯中均含有Cl2分子,故两者均为黄绿色 | ||||
B、
| ||||
| C、Cl2可以使湿润的有色布条褪色,是因为Cl2有漂白性 | ||||
| D、氯水中分子由多到少的顺序是:H2O>Cl2>HClO |
能用排水法收集的气体是( )
| A、CO2 |
| B、H2 |
| C、HCl |
| D、NH3 |
实验室里不同化学试剂的保存方法不尽相同,①NaOH溶液 ②大理石 ③NaCl溶液 ④稀硝酸4种试剂通常各自存放在如下图所示的玻璃试剂瓶中.按照试剂瓶的顺序存放试剂序号正确的是( )


| A、①②③④ | B、②①④③ |
| C、②③④① | D、②①③④ |

 元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.
元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.
