题目内容
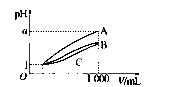 pH=1的三种酸溶液A、B、C各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的三种酸溶液A、B、C各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )| A、溶液的物质的量浓度C>B>A |
| B、酸性A>B>C |
| C、若a=4,则A是强酸,B、C是弱酸 |
| D、若1<a<4,则A、B、C都是弱酸 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:由图可知,稀释相同的倍数,A的变化大,C变化的最小,则A的酸性最强,C的酸性最弱,溶液中氢离子浓度越大,酸性越强,对于一元强酸来说c(酸)=c(H+),但对于一元弱酸,c(酸)>c(H+),以此来解答.
解答:
解:A、因A、B、C酸的强弱不同,酸越弱电离的程度越小,稀释后溶液溶质的物质的量浓度越大,所以溶液的物质的量浓度C>B>A,故A正确;
B、稀释后PH值越小酸性越强,所以酸性A<B<C,故B错误;
C、若a=4,A完全电离,则A是强酸,B、C的pH变化小,则B、C为弱酸,故C正确;
D、若1<a<4,则酸性最强的A部分电离,则A、B、C都是弱酸,故D正确;
故选B.
B、稀释后PH值越小酸性越强,所以酸性A<B<C,故B错误;
C、若a=4,A完全电离,则A是强酸,B、C的pH变化小,则B、C为弱酸,故C正确;
D、若1<a<4,则酸性最强的A部分电离,则A、B、C都是弱酸,故D正确;
故选B.
点评:本题考查酸的稀释及图象,侧重于学生的分析能力的考查,明确强酸在稀释时pH变化程度大及酸的浓度与氢离子的浓度的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、通常,同周期元素的第一电离能ⅦA族的元素最大 |
| B、主族元素的原子形成单原子离子时的化合价数都和它的族序数相等 |
| C、第ⅠA、ⅡA族元素的原子,其半径越大,第一电离能越大 |
| D、在同一主族中,自上而下第一电离能逐渐减小 |
 阿斯巴甜具有清爽的甜味,其结构简式如图所示.下列关于阿斯巴甜的说法中,不正确的是( )
阿斯巴甜具有清爽的甜味,其结构简式如图所示.下列关于阿斯巴甜的说法中,不正确的是( )| A、一定条件下可以发生酯化反应和加成反应 |
| B、完全水解,生成两种有机物 |
| C、阿斯巴甜属于糖类化合物 |
| D、在酸性条件下可以水解生成两种氨基酸 |
下列实验过程中产生的变化与对应的图形相符合的是( )
A、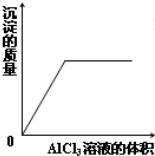 AlCl3溶液滴入NaOH溶液中 |
B、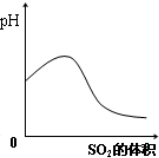 SO2气体通入氢硫酸中 |
C、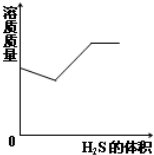 H2S气体通入NaOH溶液中 |
D、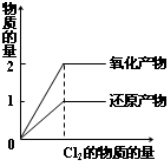 在一定量的H2S水溶液中逐渐通入Cl2 |
从元素化合价变化分析,下列变化中必须加入氧化剂才能发生的是( )
| A、SO2→S |
| B、Na2SO3→SO2 |
| C、Na→Na+ |
| D、I2→I- |
将ag光亮的铜丝在空气中加热一段时间后,迅速插入足量的下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥、称得其质量为bg.下列所插物质与铜丝的质量关系不正确的是( )
| A、CO a>b |
| B、乙醇溶液 a=b |
| C、NaHSO4 a>b |
| D、石灰水 a<b |
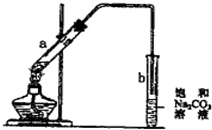 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.回答下列问题:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.回答下列问题: