题目内容
从元素化合价变化分析,下列变化中必须加入氧化剂才能发生的是( )
| A、SO2→S |
| B、Na2SO3→SO2 |
| C、Na→Na+ |
| D、I2→I- |
考点:氧化还原反应
专题:氧化还原反应专题
分析:加入氧化剂才能发生,说明题中物质具有还原性,加入氧化剂被氧化,元素的化合价升高,以此解答该题.
解答:
解:A.S元素化合价降低,应加入还原剂才能实现,故A错误;
B.元素化合价没有发生变化,不是氧化还原反应,故B错误;
C.Na元素化合价升高,被氧化,应加入氧化剂,故C正确;
D.I元素化合价降低,应加入还原剂才能实现,故D错误;
故选C.
B.元素化合价没有发生变化,不是氧化还原反应,故B错误;
C.Na元素化合价升高,被氧化,应加入氧化剂,故C正确;
D.I元素化合价降低,应加入还原剂才能实现,故D错误;
故选C.
点评:本题考查氧化还原反应,为高考常见题型,侧重于学生的分析能力的考查,题目较为基础,难度不大,注意把握元素化合价的判断.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
下列说法不正确的是( )
| A、可用铁氰酸钾溶液检验硫酸亚铁铵溶液中的亚铁离子 |
| B、可用淀粉溶液检验海带灰浸出液中的碘元素 |
| C、可用纸层析法分离铁离子与铜离子,分离时,蓝色斑点在棕色斑点的下方,说明铜离子在固定相中分配得更多 |
| D、过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离方法 |
25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2CO3)>pH(NaCN) |
| B、a mol?L-1HCN溶液与b mol?L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b |
| C、0.1 mol?L-1CH3COOH溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
| D、NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
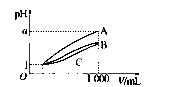 pH=1的三种酸溶液A、B、C各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的三种酸溶液A、B、C各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )| A、溶液的物质的量浓度C>B>A |
| B、酸性A>B>C |
| C、若a=4,则A是强酸,B、C是弱酸 |
| D、若1<a<4,则A、B、C都是弱酸 |
由以下两种途径制铜:
(1)CuO
CuSO4
Cu
(2)Zn
H2
Cu
假设每一步反应都完全,要制得等质量的铜,两个途径相比较,下列有关说法正确的是( )
(1)CuO
| H2SO4 |
| Zn |
(2)Zn
| H2SO4 |
| CuO |
假设每一步反应都完全,要制得等质量的铜,两个途径相比较,下列有关说法正确的是( )
| A、消耗等物质的量的Zn、H2SO4、CuO |
| B、所有反应类型都相同 |
| C、过程中产生的ZnSO4质量相同 |
| D、只有CuO消耗的质量相同 |
下列变化中,不可能通过一步反应实现的是( )
| A、Cu→CuSO4 |
| B、Fe→FeCl3 |
| C、NH3→NO |
| D、SiO2→H2SiO3 |

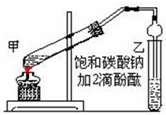 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下: