题目内容
下列事实不能说明醋酸为弱酸的是( )
| A、稀醋酸溶液的导电性比较弱 |
| B、向CH3COONa溶液中滴入酚酞试液,溶液变红色 |
| C、一定温度下,向某醋酸溶液中加入CH3COONH4晶体,溶液pH增大 |
| D、一定温度下,向体积相同,pH值也相同的盐酸和醋酸中,投入相同质量的锌粒,锌粒完全溶解所消耗的时间不同 |
考点:弱电解质的判断
专题:
分析:弱电解质在水溶液里或熔融状态下只有部分电离,根据醋酸的电离程度判断.
解答:
解:A.稀醋酸溶液浓度小,导电性比较弱,不能说明醋酸是弱电解质,故A选;
B.CH3COONa是强碱弱酸盐,水解显碱性,溶液中滴入酚酞试液,溶液变红色,能说明醋酸是弱电解质,故B不选;
C.一定温度下,向某醋酸溶液中加入CH3COONH4晶体,醋酸根水解显碱性,溶液pH增大,说明醋酸是弱电解质,故C不选;
D.取同体积,同pH值的盐酸和醋酸与相同质量的锌粒反应,醋酸所消耗的时间短,说明醋酸的物质的量浓度大于盐酸,则醋酸不完全电离,为弱电解质,故D不选;
故选A.
B.CH3COONa是强碱弱酸盐,水解显碱性,溶液中滴入酚酞试液,溶液变红色,能说明醋酸是弱电解质,故B不选;
C.一定温度下,向某醋酸溶液中加入CH3COONH4晶体,醋酸根水解显碱性,溶液pH增大,说明醋酸是弱电解质,故C不选;
D.取同体积,同pH值的盐酸和醋酸与相同质量的锌粒反应,醋酸所消耗的时间短,说明醋酸的物质的量浓度大于盐酸,则醋酸不完全电离,为弱电解质,故D不选;
故选A.
点评:本题考查了弱电解质的判断,电解质强弱是根据其电离程度划分的,不能根据溶液导电性强弱划分,为易错点.

练习册系列答案
相关题目
下列实验设计和结论相符的是( )
| A、测定中和热:取25 mL0.25 mol/L的硫酸溶液和25 mL0.5 mol/LNaOH溶液中和,测定反应放出的热 |
| B、在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
| C、将SO2与CO2的混合气通过品红溶液洗气后,可除去CO2中的SO2 |
| D、向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,可除去Ca(OH)2 |
下列关于有机物的说法中不正确的是( )
| A、正丁烷和异丁烷的一氯取代物都只有两种,它们的密度也相同 |
| B、乙烯、甲苯、乙酸分子中的碳原子都在同一平面上 |
| C、等物质的量的乙烯和乙醇蒸气完全燃烧消耗的氧气及生成的CO2的物质的量都相等 |
| D、0.3mol的混合烃充分燃烧后,标准状况下生成11.2L CO2气体,该烃中一定含有甲烷 |
下列说法正确的是( )
| A、向AgCl悬浊液中加入少量NaCl固体后振荡,c(Cl-)增大,KsP (AgCl)增大 |
| B、某溶液中由水电离出的c(H+)=1.0×10-amol/L,若a>7时,则该溶液的pH一定为14-a |
| C、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后溶液的pH等于7,则混合溶液中:c(R2-)+c(HR-)=c(Na+) |
| D、相同物质的量浓度的①NH4Al(SO4)2 ②NH4Cl③CH3COONH4 ④NH3?H2O溶液中,c(NH4+)由大到小的顺序是:①>②>③>④ |
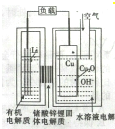 近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A、放电时,Li+透过固体电解质向Cu极移动 |
| B、放电时,负极的电极反应式为CuO+H2O+2e---Cu+2OH- |
| C、通空气时,铜被腐蚀,表面产生Cu2O |
| D、整个反应过程中,铜相当于催化剂 |
设NA 表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA |
| B、常温常压下,18 g H2O 中含有的原子总数为3NA |
| C、1 L 0.1 mol?L-1NaHCO3液含有0.1NA个HCO3- |
| D、常温常压下,2.24 L CO 和CO2 混合气体中含有的碳原子数目为0.1NA |