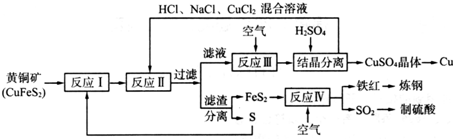
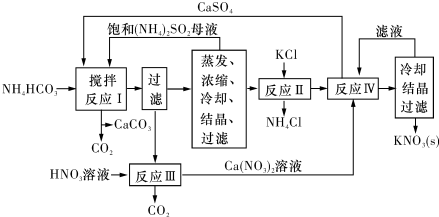
题目内容
13.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是参与反应的物质和水分别离解成两部分,再重新组合新的物质.根据上述观点,下列说法不正确的是( )| A. | PCl3的水解产物是PH3和HCl | B. | CuCl2的水解产物是Cu(OH)2和HCl | ||
| C. | NaClO的水解产物是HClO和NaOH | D. | CaO2的水解产物是Ca(OH)2和H2O2 |
分析 根据题意信息:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质,所以将物质分为阴离子和阳离子两部分,阳离子和氢氧根结合即为产物,阴离子和氢离子结合即为产物.
解答 解:A、PCl3的水解产物是HCl和P(OH)3,故A错误;
B、CuCl2的水解产物是铜离子和氢氧根离子结合生成的Cu(OH)2,氯离子和氢离子结合生成的HCl,故B正确;
C、NaClO的水解产物是钠离子和氢氧根离子结合生成的NaOH,次氯酸根离子和氢离子结合生成的HClO,故C正确;
D、CaO2的水解产物钙离子和氢氧根离子结合生成的Ca(OH)2和过氧根离子和氢离子结合生成的H2O2,故D正确;
故选A.
点评 本题是一道信息给定题,注意知识的迁移和应用,属于开放式的题目,难度不大.

练习册系列答案
相关题目
1.下列离子方程式中,不正确的是( )
| A. | 浓烧碱溶液中加入铝片:A1+2OH-+2H2O═[A1(OH)4]-+H2↑ | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3一═CaCO3↓+H2O | |
| C. | 食醋和小苏打溶液混合;CH3COOH+HCO3一═CH3COO-十H2O+CO2↑ | |
| D. | 敞开体系,向FeC12溶液滴加NaOH溶液:4Fe2++8OH-+O2+2H2O═4Fe (OH)3↓ |
8.光导纤维的主要成分是二氧化硅,下列关于二氧化硅的说法正确的是( )
| A. | 二氧化硅能与水反应 | |
| B. | 用二氧化硅制取单质硅,当生成2.24 L(标准状况下)气体时,得到2.8g硅 | |
| C. | 二氧化硅属于传统的无机非金属材料 | |
| D. | 二氧化硅不能与碳酸钠溶液发生反应,但在高温下能与碳酸钠固体发生反应 |
18.在溶液中加入足量的过氧化钠后仍能大量共存的离子组是( )
| A. | K+、AlO2-、Cl-、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ca2+、Fe2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、HSO32- |
5.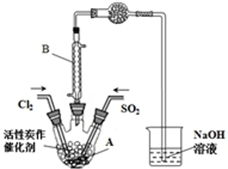 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
(1)若用浓盐酸与高锰酸钾为原料制取Cl2,则反应的离子方程式为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O;
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择A;
A.冰水浴 B.常温 C.加热至69.1℃D.沸水浴
(4)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O═H2SO4+2HCl;反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为X g、Y g.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率为(用含X、Y的代数式表示)$\frac{x}{x+y}$×100%.
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示. | SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择A;
A.冰水浴 B.常温 C.加热至69.1℃D.沸水浴
(4)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O═H2SO4+2HCl;反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为X g、Y g.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率为(用含X、Y的代数式表示)$\frac{x}{x+y}$×100%.
2.化学在生产和生活中有重要的应用.下列说法正确的是( )
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
3.某离子反应中共有H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中C(ClO-)随反应进行逐渐减小.下列判断错误的是( )
| A. | 该反应的还原剂是NH4+ | |
| B. | 消耗1mol氧化剂,转移2mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比是2:3 | |
| D. | 反应后溶液酸性明显增强 |